题目内容
(1)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式________________________.
(2)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式________________________________.
(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是________________(用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式________________________________.
(4)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物与NaOH溶液反应的离子方程式:________________________________.
(2)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式________________________________.
(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是________________(用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式________________________________.
(4)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物与NaOH溶液反应的离子方程式:________________________________.
(1)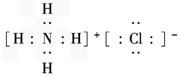
(2)2F2+2H2O==4HF+O2
(3)r(Cl-)>r(Ca2+);2Mg+CO2 2MgO+C
2MgO+C
(4)Al(OH)3+OH-===AlO2-+2H2O
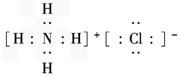
(2)2F2+2H2O==4HF+O2
(3)r(Cl-)>r(Ca2+);2Mg+CO2
 2MgO+C
2MgO+C(4)Al(OH)3+OH-===AlO2-+2H2O

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
(12分)有A、B、C 、D、E、F、G 六种前四周期元素,原子序数依次增大,其相关信息如下表:
|
元素编号 |
相关信息 |
|
A |
所处的周期数、族序数分别与其原子序数相等 |
|
B |
基态时,电子分布在三个能级上,且各能级中电子数相等 |
|
C |
基态时, 2p 轨道处于半充满状态 |
|
D |
与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
|
E |
原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
F |
与E同周期,原子核外所有p轨道:有的全满有的半满 |
|
G |
是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)A、B两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为 ,其中B原子采取 杂化。
(2)B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)。
(3)C的氢化物比F的氢化物的沸点__________(填“高”或“低”),C的氢化物比F的氢化物的稳定性__________(填“强”或“弱”)。
(4)A2D的VSEPR模型名称为__________;
写出与A2D分子互为等电子体的微粒__________(填一种)
(5)写出E3C2的电子式 ;
(6)G的基态原子核外电子排布式为 。
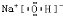

 AlO2-+H++H2O
AlO2-+H++H2O (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表: