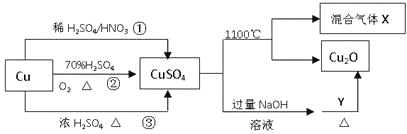
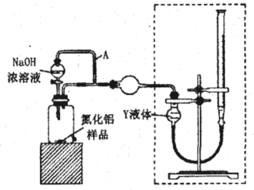
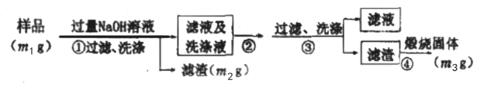
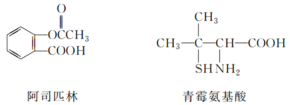题目内容
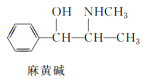
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,经如下处理:

已知氯化铁溶液可用于腐蚀印刷电路铜板的离子反应为:Cu+2Fe3+=Cu2++2Fe2+
下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中氧元素的物质的量为0.03mol
③溶解样品的过程中消耗硫酸的总物质的量为0.04mol
④V=224
⑤V=336
A.①③④B.②③④C.②③⑤D.①③⑤
【答案】B
【解析】
①铜不与稀硫酸反应,则生成的滤渣3.2g为铜,金属铜可以和三价铁反应,所以滤液A中一定不含有+3价铁离子,故①错误;
②最后加热得到的3.2g固体为三氧化二铁,其物质的量为:![]() ,Fe元素的物质的量为
,Fe元素的物质的量为![]() ,铁元素的质量为
,铁元素的质量为![]() ,则样品中氧元素的质量为:
,则样品中氧元素的质量为:![]() ,氧元素的物质的量为
,氧元素的物质的量为![]() ,故②正确;
,故②正确;
③根据②铁元素的物质的量为0.04mol,铁与过量稀硫酸反应生成硫酸亚铁,则反应消耗硫酸的物质的量为0.04mol,故③正确;
④最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,根据②可知氧元素的物质的量为0.03mol,它结合氢离子0.06mol,所以硫酸中生成氢气的氢离子为:0.08mol-0.06mol=0.02mol,即生成0.01mol氢气,标况体积为0.01mol氢气的体积为2.24L,故④正确;
⑤根据④的计算可知,生成标况下氢气的体积为2.24L,故⑤错误;根据以上分析可知,正确的为:②③④,
故选:B。

【题目】过氧化氢是重要的化工产品,广泛应用于化学合成、医疗消毒等领域。
(1)过氧化氢的电子式为_____________。
(2)工业上电解硫酸氢盐溶液得到过二硫酸盐(![]() ),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。
),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。
(3)298K时,实验测得反应![]() 在不同浓度时的化学反应速率如表:
在不同浓度时的化学反应速率如表:
实验编号 | 1 | 2 | 3 | 4 | |
c(HI) /mol﹒L-1 | 0.100 | 0.200 | 0.300 | 00.100 | 0.100 |
c(H2O2)/mol﹒L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v//mol﹒L-1﹒s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
已知速率方程为![]() ,其中k为速率常数。
,其中k为速率常数。
根据表中数据判断:a=_______,b=________。
(4)“大象的牙膏”实验是将浓缩的过氧化氢与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。反应中H2O2的分解机理为:
![]() 慢
慢
![]() 快
快
此反应过程中无催化剂和有催化剂的能量变化关系图像如图所示:
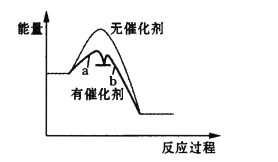
则表示慢反应的曲线是__________(填“a”或“b”)。
1mol H2O2分解放出热量98 kJ,则H2O2分解的热化学方程式为_________________。
(5)某科研团队研究![]() 体系(其中
体系(其中![]() )氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图:
)氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图:
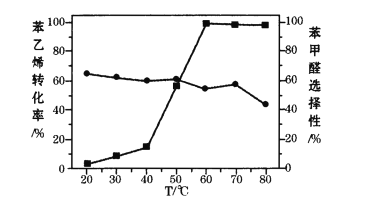
注:■苯乙烯转化率 ●苯甲醛选择性
①80℃时苯乙烯的转化率有所降低,其原因可能是_______。
②结合苯乙烯的转化率,要获得较高的苯甲醛产率,应该选择的温度为_______。