题目内容
5.对于平衡体系mA(g)+nB(g)?pC(g)+qD(g) 按题目的要求写出可能采取的措施.(1)正、逆反应速率都改变,但平衡不移动,则改变的条件可能是:①加入催化剂,②若m+n=p+q,则改变的条件是压强.
(2)只改变正反应速率或只改变逆反应速率,则改变的条件可能是单独改变反应物浓度或是单独改变生成物浓度.
(3)正、逆反应速率发生不同程度的变化,则改变的条件可能是:①改变温度,②若m+n≠p+q,则改变的条件是压强.
分析 (1)如m+n=p+q,则增大压强或加入催化剂,平衡不移动;
(2)改变反应物或生成物的浓度,则只改变正反应速率或只改变逆反应速率;
(3)改变温度,正、逆反应速率发生不同程度的变化,如m+n≠p+q,则改变压强平衡发生移动.
解答 解:(1)如m+n=p+q,则增大压强或加入催化剂,正、逆反应速率都增大,平衡不移动,故答案为:加入催化剂;m+n=p+q;
(2)改变反应物或生成物的浓度,则只改变正反应速率或只改变逆反应速率,故答案为:反应物浓度;生成物浓度;
(3)改变温度,正、逆反应速率发生不同程度的变化,如m+n≠p+q,则改变压强平衡发生移动,正、逆反应速率发生不同程度的变化,故答案为:改变温度;m+n≠p+q.
点评 本题考查学生化学平衡移动、化学平衡影响因素,难度中等,注意对于反应前后气体体积不变的反应,压强变化不引起平衡移动,注意改变压强的实质是引起浓度变化.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
15. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 电流由O2所在的铂电极流出 | |
| B. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| C. | O2所在的铂电极处发生还原反应 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
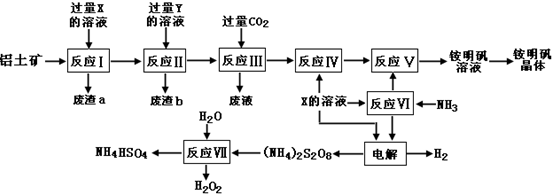
20.用含有少量SiO2(酸性氧化物)的铝片制取纯净的氢氧化铝,有下列操作步骤,最恰当的组合是(按先后顺序排列)( )
①加盐酸溶解
②加过量烧碱溶液溶解
③过滤
④通入过量CO2生成Al(0H)3沉淀
⑤加入盐酸,生成Al(0H)3沉淀
⑥加入过量氨水溶液,生成Al(0H)3沉淀.
①加盐酸溶解
②加过量烧碱溶液溶解
③过滤
④通入过量CO2生成Al(0H)3沉淀
⑤加入盐酸,生成Al(0H)3沉淀
⑥加入过量氨水溶液,生成Al(0H)3沉淀.
| A. | ①③⑥③ | B. | ②③⑥③ | C. | ②③④③ | D. | ②③⑤③ |
10.恒温下,下列各组离子在指定溶液中-定能大量共存的是( )
| A. | 与铝反应产生氢气的溶液中:Na+、NH4+、SO42-、CH3C00- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:NH4+、Cl-、AlO2-、SO42- | |
| C. | 使甲基橙变红的溶液中:K+、Al3+、SO42-、NO3- | |
| D. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I- |
17.某烃的一种同分异构体只能生成一氯代物,该烃的分子式不可以是( )
| A. | C3H6 | B. | C5H12 | C. | C6H14 | D. | C8H18 |
14.一定条件下,将aL SO3气体通过装有V2O5的硬质试管后,气体体积变为bL(气体体积均在同温同压下测定),该bL气体中SO3的体积分数是( )
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
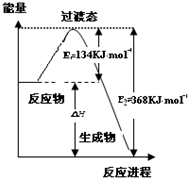 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.