题目内容
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH﹣、Al(OH)3、NO3﹣、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3﹣+ + → + + ﹣ 该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H="+b" KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为 L(标准状况)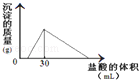
(1)10Al、18H2O=10Al(OH)3、3N2、6OH﹣;5:3
(2)2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣(a﹣b﹣c)KJ/mol
(3)2.016
解析试题分析:(1)反应中NO3﹣→N2,N元素化合价由+5价降低为0价,共降低10价,
Al→Al(OH)3,Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH﹣是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据N元素守恒可知NO3﹣系数为6,根据Al元素守恒可知Al(OH)3系数为10,电荷守恒可知OH﹣系数为6,根据H元素守恒可知H2O系数为,配平后离子方程式为6NO3﹣+10Al+18H2O=10Al(OH)3+3N2+6OH﹣.由方程式可知被氧化与被还原的元素的物质的量之比10:6=5:3.故答案为:10Al、18H2O=10Al(OH)3、3N2、6OH﹣;5:3.
(2)已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
②Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H="+b" KJ/mol
③C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
由盖斯定律可知,②﹣③× +①×得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)
△H=﹣(a﹣b﹣c)KJ/mol.
故答案为:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣(a﹣b﹣c)KJ/mol.
(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH﹣)+n(AlO2﹣),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,根据钠元素守恒有n(NaCl)=n(Na)=n(Na+)=0.06mol,PH=14的溶液中c(OH﹣)=1mol/L,n(OH﹣)=0.02L×1mol/L=0.02mol,所以n(AlO2﹣)=0.06mol﹣0.02mol=0.04mol,所以n(Al)=n(AlO2﹣)=0.04mol,根据电子转移守恒n(H2)×2=n(Na)×1+n(Al)×3,2n(H2)=0.06mol+0.04mol×3=0.18mol,故n(H2)=0.09mol,V(H2)=0.09mol×22.4L/mol=2.016L.故答案为:2.016.
考点:氧化还原反应;用盖斯定律进行有关反应热的计算;有关混合物反应的计算.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量 浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
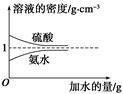
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________ mol·L-1。
(3)将物质的量浓度分别为c2 mol·L-1和
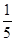 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ 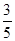 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。 某草酸盐晶体KxFey(C2O4)z?wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| | 120℃ | 300℃ | 480℃ |
| 化学式 | KxFey(C2O4)z | KxFeyO(C2O4)z-1 | KxFeyO2(C2O4)z-2 |
| 质量 | 4.370g | 3.650g | 2.930 g |
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为 (保留三位小数);
(2)R的化学式为 ;
(3)草酸盐晶体的摩尔质量为 ;
(4)试通过计算,确定草酸盐晶体的化学式。
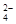 ,SO
,SO