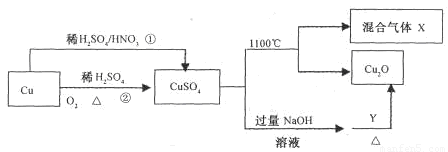
题目内容
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是

- A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
- B.相对于途径①、③,途径②更好地体现了绿色化学思想
- C.1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol
- D.Y可以是葡萄糖
C
试题分析:1molCuSO4在1100℃所得混合气体X为SO2,O2,其中存在可逆反应SO2+O2 SO3,O2不一定为0.75mol
SO3,O2不一定为0.75mol
考点:CuSO4的制备
点评:本题考查CuSO4的制备,做题时,应注意框图之间各物质的联系,利用可逆反应的特征来解题。考查学生的综合能力,难度一般。
试题分析:1molCuSO4在1100℃所得混合气体X为SO2,O2,其中存在可逆反应SO2+O2
 SO3,O2不一定为0.75mol
SO3,O2不一定为0.75mol考点:CuSO4的制备
点评:本题考查CuSO4的制备,做题时,应注意框图之间各物质的联系,利用可逆反应的特征来解题。考查学生的综合能力,难度一般。

练习册系列答案
相关题目
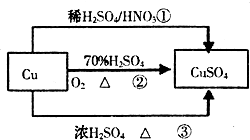 CuSO4是一种重要的化工原料,有关制备途径及性质如图所示.下列说法错误的是( )
CuSO4是一种重要的化工原料,有关制备途径及性质如图所示.下列说法错误的是( )| A、途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | B、相对于途径①、③,途径②更好地体现了绿色化学思想 | C、生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③ | D、利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol |
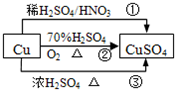 CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )
CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)
| A、相对于途径①、③,途径②更好地体现了绿色化学思想 | B、途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 | C、途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | D、1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为1:1 |