题目内容
已知甲、乙、丙、丁代表4种纯净物.甲(g)+2乙(g)?丙(g)+丁(g)△H=-a kJ?mol-1(a>0),下列说法正确的是( )
| A、甲(g)的能量一定大于丙(g)的能量 | B、该反应不需要加热 | C、1 mol甲(g)与2 mol乙(g)的总能量高于1 mol丙(g)和1 mol丁(g)的总能量 | D、该反应表示:1 mol甲(g)与2 mol乙(g)在一定条件下反应放出的热量为a kJ?mol-1 |
分析:△H=-a kJ?mol-1(a>0),该反应正反应是放热反应,它只表示反应物1 mol甲(g)与2 mol乙(g)的总能量高于生成物1 mol丙(g)和1 mol丁(g)的总能量,并不能表示甲(g)的能量一定大于丙(g)的能量;反应吸热还是放热与反应条件无关,很多放热反应也必须先加热才能进行;该反应方程式表示1 mol甲(g)与2 mol乙(g)恰好完全反应生成气态丙和气态丁时放出的热量为a kJ,由于该反应是可逆反应,1 mol甲(g)与2 mol乙(g)并不能完全反应,放出的热量小于a kJ.
解答:解:A、该热化学方程式表示反应物1 mol甲(g)与2 mol乙(g)的总能量高于生成物1 mol丙(g)和1 mol丁(g)的总能量,并不能表示甲(g)的能量一定大于丙(g)的能量,故A错误;
B、反应吸热还是放热与反应条件无关,很多放热反应也必须先加热才能进行,故B错误;
C、该反应为放热反应,因此1 mol甲(g)与2 mol乙(g)的总能量高于生成物1 mol丙(g)和1 mol丁(g)的总能量,故C正确;
D、该反应方程式表示1 mol甲(g)与2 mol乙(g)恰好完全反应生成气态丙和气态丁时放出的热量为a kJ,由于该反应是可逆反应,1 mol甲(g)与2 mol乙(g)并不能完全反应,放出的热量小于a kJ,故D错误;
故选:C.
B、反应吸热还是放热与反应条件无关,很多放热反应也必须先加热才能进行,故B错误;
C、该反应为放热反应,因此1 mol甲(g)与2 mol乙(g)的总能量高于生成物1 mol丙(g)和1 mol丁(g)的总能量,故C正确;
D、该反应方程式表示1 mol甲(g)与2 mol乙(g)恰好完全反应生成气态丙和气态丁时放出的热量为a kJ,由于该反应是可逆反应,1 mol甲(g)与2 mol乙(g)并不能完全反应,放出的热量小于a kJ,故D错误;
故选:C.
点评:本题考查化学反应中能量的变化,着重于对概念的理解,难度不大,放热反应、吸热反应与反应条件之间有无必然关系,D选项注意可逆反应不能进行到底.

练习册系列答案
相关题目

 )
)
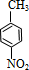
 +HOCH2CH2Cl
+HOCH2CH2Cl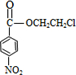 +H2O
+H2O




 )
)
 +HOCH2CH2Cl
+HOCH2CH2Cl

 +HCl
+HCl