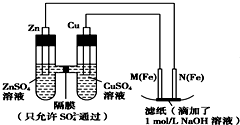
题目内容
11.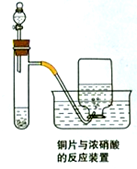 如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:(1)写出试管内发生反应的化学方程式Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)描述在实验过程中观察到的颜色变化:
试管内液体呈绿色;试管内液体上方气体呈红棕色;集气瓶内收集到的气体呈无色.
(3)在反应一段时间后,从分液漏斗处向试管内加入蒸馏水,请描述加水后试管内和集气瓶内颜色的变化情况:试管内液体呈蓝色;试管内液体上方气体呈无色.
分析 (1)硝酸具强氧化性,能把不活泼的金属铜氧化成铜离子,同时被还原成二氧化氮;
(2)试管内的溶液是硝酸铜溶液,铜与浓硝酸反应后溶液颜色呈现绿色.原因是产生的红棕色二氧化氮气体一部分溶解在溶液中呈黄色,而溶液中[Cu(H2O)4]2+呈蓝色;
(3)从分液漏斗处向试管内加入蒸馏水,二氧化氮气体和水反应,溶液呈现铜离子的颜色,所以试管内液体是蓝色,二氧化氮与水反应生成硝酸和一氧化氮.
解答 解:(1)硝酸具强氧化性,能把不活泼的金属铜氧化成铜离子,同时被还原成二氧化氮,化学方程式为:Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O;
故答案为:Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)试管内的溶液是硝酸铜溶液,铜与浓硝酸反应后溶液颜色呈现绿色.原因是产生的红棕色二氧化氮气体一部分溶解在溶液中呈黄色,而溶液中[Cu(H2O)4]2+呈蓝色,两者的混合色为绿色;
试管内液体上方的气体是二氧化氮,二氧化氮呈红棕色,所以试管内液体上方的气体呈红棕色;
二氧化氮气体和水反应生成无色气体NO,3NO2+H2O=2HNO3+NO,所以集气瓶内收集到的气体呈无色.
故答案为:绿;红棕;无;
(3)从分液漏斗处向试管内加入蒸馏水,二氧化氮气体和水反应,溶液呈现铜离子的颜色,所以试管内液体是蓝色;
3NO2+H2O=2HNO3+NO,NO是无色的,所以试管内液体上方气体呈无(或红棕色变浅)色.
故答案为:蓝;无(或红棕色变浅).
点评 注意以下几点:
1、硝酸铜溶液的颜色呈蓝色,但铜与浓硝酸反应后溶液颜色却会呈现绿色.原因是产生的红棕色二氧化氮气体一部分溶解在溶液中呈黄色,而溶液中[Cu(H2O)4]2+呈蓝色,两者的混合色为绿色.
2、足量的铜与一定量的浓硝酸反应,先发生的反应是铜和浓硝酸的反应,生成的气体是二氧化氮;随着反应的进行,当硝酸的浓度达到一定值后,变成稀硝酸,生成的气体变成一氧化氮.

 阶梯计算系列答案
阶梯计算系列答案| A. | 1体积NO | B. | 1体积NO2和$\frac{1}{2}$体积O2 | ||
| C. | $\frac{1}{4}$体积O2 | D. | $\frac{1}{3}$体积NO |
①金属钠投入到FeCl2溶液中 ②过量NaOH溶液和AlCl3溶液混合
③少量Ca(OH)2投入NaHCO3溶液中 ④过量CO2通入Na[Al(OH)4]溶液中.
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
| A. | 石油属于可再生矿物能源 | B. | 石油主要含有碳、氢两种元素 | ||
| C. | 石油的裂化是物理变化 | D. | 石油分馏的各馏分均是纯净物 |
| A. | H2CO3 | B. | CH3CH2OH | C. | CO | D. | CO2 |
| A. | HCOOCH3 与CH3CH2COOH | B. | C2H4、C3H6 | ||
| C. | CH3-CH═CH2 与CH3-CH═CH2 | D. | CH4、C3H8 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲基的电子式: | ||
| C. | 乙醇的分子式:C2H5OH | D. | 二氧化碳的电子式: |
 .
. .
.