题目内容
开发新型储氢材料是氢能利用的重要研究方向.某物质R是一种储氢材料.现取84g R在高温条件下加热分解,得到0.5mol离子化合物A(只含有二种短周期元素)和44.8L气体B(气体体积为标准状况下),该气体能使湿润的红色石蕊试纸变蓝.已知A中两种离子的电子层结构相同,且阳离子的核电荷数比阴离子多5,气体B有如下转化关
系:B
C
D
E,E是一种强酸.请回答下列问题:
(1)物质A的化学式为 .
(2)写出R高温分解的化学方程式 .
(3)将C和D的混合物溶解在接近0℃的水中,即可得到一种弱酸F的水溶液.弱酸F比醋酸酸性稍强,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是 (填序号).
a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)有一种活性很强的离子化合物G,其组成为NH5,电子式为 ,NH5与水反应能否产生H2 (填“能”或“否”),理由是 .
(5)现有9.6g A中的金属单质与极稀的E溶液充分反应无气体产生,加入足量的NaOH溶液并微热,生成B气体(标准状况下) L.
系:B
| X |
| X |
| H2O |
(1)物质A的化学式为
(2)写出R高温分解的化学方程式
(3)将C和D的混合物溶解在接近0℃的水中,即可得到一种弱酸F的水溶液.弱酸F比醋酸酸性稍强,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是
a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)有一种活性很强的离子化合物G,其组成为NH5,电子式为
(5)现有9.6g A中的金属单质与极稀的E溶液充分反应无气体产生,加入足量的NaOH溶液并微热,生成B气体(标准状况下)
考点:无机物的推断
专题:推断题
分析:44.8L气体B(气体体积为标准状况下),该气体能使湿润的红色石蕊试纸变蓝,气体为氨气,n(NH3)=
=2mol,A为只含有二种短周期元素形成的离子化合物,A中两种离子的电子层结构相同,且阳离子的核电荷数比阴离子多5,由Na、Mg、Al及N、O、F,则A为Mg3N2符合,0.5molA中含1.5molMg、1molN,M(R)=
=56g/mol,Mg的摩尔质量为24g/mol,则R为Mg(NH2)2;
气体B有如下转化关系:B
C
D
E,E是一种强酸,则C为NO、D为NO2,E是硝酸,然后结合物质的性质来解答.
| 44.8L |
| 22.4L/mol |
| 84g |
| 1.5mol |
气体B有如下转化关系:B
| X |
| X |
| H2O |
解答:
解:44.8L气体B(气体体积为标准状况下),该气体能使湿润的红色石蕊试纸变蓝,气体为氨气,n(NH3)=
=2mol,A为只含有二种短周期元素形成的离子化合物,A中两种离子的电子层结构相同,且阳离子的核电荷数比阴离子多5,由Na、Mg、Al及N、O、F,则A为Mg3N2符合,0.5molA中含1.5molMg、1molN,M(R)=
=56g/mol,则R为Mg(NH2)2;
(1)由上述分析可知,A的化学式为Mg3N2,故答案为:Mg3N2;
(2)R高温分解的化学方程式为3Mg(NH2)2
Mg3N2+4NH3↑,故答案为:3Mg(NH2)2
Mg3N2+4NH3↑;
(3)B
C
D
E,E是一种强酸,则C为NO、D为NO2,E是硝酸,NO2+NO+H2O=2HNO2,F为亚硝酸依据其弱酸性、氧化性和还原性,亚硝酸比醋酸酸性稍强,而碳酸的酸性比醋酸弱,亚硫酸有强还原性,故不能选择CO2和SO2,故答案为:bd;
(4)NH5的电子式为: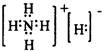 ,NH5分子中负一价的氢有强还原性,要与水中正一价的氢发生归中反应生成氢气,
,NH5分子中负一价的氢有强还原性,要与水中正一价的氢发生归中反应生成氢气,
故答案为: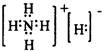 ;能;NH4H中-1价的H与H2O中+1价的H发生归中反应;
;能;NH4H中-1价的H与H2O中+1价的H发生归中反应;
(5)根据得失电子守恒,可知关系式为4Mg~NH3,则
4Mg~NH3
4×24g 22.4L
9.6g 2.24L
故答案为:2.24.
| 44.8L |
| 22.4L/mol |
| 84g |
| 1.5mol |
(1)由上述分析可知,A的化学式为Mg3N2,故答案为:Mg3N2;
(2)R高温分解的化学方程式为3Mg(NH2)2
| ||
| ||
(3)B
| X |
| X |
| H2O |
(4)NH5的电子式为:
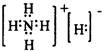 ,NH5分子中负一价的氢有强还原性,要与水中正一价的氢发生归中反应生成氢气,
,NH5分子中负一价的氢有强还原性,要与水中正一价的氢发生归中反应生成氢气,故答案为:
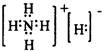 ;能;NH4H中-1价的H与H2O中+1价的H发生归中反应;
;能;NH4H中-1价的H与H2O中+1价的H发生归中反应;(5)根据得失电子守恒,可知关系式为4Mg~NH3,则
4Mg~NH3
4×24g 22.4L
9.6g 2.24L
故答案为:2.24.
点评:本题考查无机物的推断,为高频考点,把握A、B的推断为解答本题的关键,注意氨气的性质及A为离子化合物及离子的特点为推断的突破口,侧重分析能力、计算能力、推断能力的综合考查,题目难度较大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
浓硫酸和浓硝酸是实验室常用的酸,下列关于它们的说法错误的是( )
| A、浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气 |
| B、浓硫酸和浓硝酸都能与单质碳反应 |
| C、浓硫酸和浓硝酸加水稀释后都能与金属铜反应 |
| D、浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 |
化学与人类生活、社会可持续发展密切相关.下列说法不正确的是( )
| A、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B、催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 |
| C、研发高效低毒的农药,降低蔬菜的农药残留量 |
| D、积极开发废电池的综合利用技术,防止电池中的重金属等污染土壤和水体 |
下列说法中,不正确的是( )
| A、在元素周期表里,元素所在主族的族序数等于其原子核外最外层电子数 |
| B、在元素周期表里,元素所在的周期数等于原子电子层数 |
| C、最外层电子数为8的微粒是稀有气体元素的原子 |
| D、同主族元素的原子序数越大,其原子半径越大 |
 化学能转变成热能、化学能转变成电能是能量转化的重要形式.
化学能转变成热能、化学能转变成电能是能量转化的重要形式.
