题目内容
【题目】在100 ℃时,将0.100 mol的N2O4气体充入1 L 抽空的密闭容器中,发生如下反应:N2O4![]() 2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
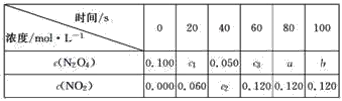
(1)达到平衡时,N2O4的转化率为______________,表中c2________c3,a________b(填“>”、“<”或“=”)。
(2)20 s时N2O4的浓度c1=________ mol·L-1,在0~20 s内N2O4的平均反应速率为________ mol·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,则要达到上述同样的平衡状态,二氧化氮的起始浓度是________ mol·L-1。
【答案】60 > = 0.07 0.0015 0.20
【解析】
(1)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;根据方程式计算,计算c2、c3,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);根据v=![]() 计算v(N2O4);
计算v(N2O4);
(3)达到上述同样的平衡状态,说明两个平衡为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L;
(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,根据反应N2O42NO2可知,平衡时消耗二氧化氮的浓度为:c(N2O4)=0.120mol/L×![]() =0.06mol/L,则平衡时N2O4的转化率为:
=0.06mol/L,则平衡时N2O4的转化率为: ![]() ×100%=60%;达到平衡时各组分的浓度不再变化,则c3=a=b=0.1mol/L0.06mol/L=0.04mol/L;由表可知,40s时,c(N2O4)=0.050mol/L,N2O4的浓度变化为:(0.10.05)mol/L=0.05mol/L,则c2=0.05mol/L×2=0.10mol/L,所以c2>c3,
×100%=60%;达到平衡时各组分的浓度不再变化,则c3=a=b=0.1mol/L0.06mol/L=0.04mol/L;由表可知,40s时,c(N2O4)=0.050mol/L,N2O4的浓度变化为:(0.10.05)mol/L=0.05mol/L,则c2=0.05mol/L×2=0.10mol/L,所以c2>c3,
故答案为:60;>;=;
(2)由表可知,20s时,c(NO2)=0.060mol/L,则反应消耗N2O4的浓度为0.030mol/L,则20s的四氧化二氮的浓度c1=0.1mol/L0.03mol/L=0.07mol/L;在0s20s内四氧化二氮的平均反应速率为v(N2O4)=![]() =0.0015mol(Ls)1,
=0.0015mol(Ls)1,
故答案为:0.07;0.0015;
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L即可,根据反应N2O42NO2可知二氧化氮的浓度应该为:c(NO2)=2c(N2O4)=0.1mol/L×2=0.20mol/L,
故答案为:0.20。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】现有部分短周期元素的原子结构如下表:
元素编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:____________,元素Y的最简单氢化物的化学式为______________。
(2)Z元素原子的相对原子质量为____________。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________。
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为__________________。
【题目】![]() 资源化利用的方法之一是合成二甲醚(
资源化利用的方法之一是合成二甲醚(![]() 简写做
简写做![]() )。
)。![]() 催化加氢法合成
催化加氢法合成![]() ,其过程中主要发生下列反应:
,其过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
其中,反应Ⅱ分以下两步完成,请写出反应Ⅳ的热化学方程式。
反应Ⅲ:![]()
![]()
反应Ⅳ:___________。
⑴反应Ⅳ的热化学方程式为________。
⑵在![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 的平衡转化率和平衡时
的平衡转化率和平衡时![]() 、
、![]() 的选择性随压强或温度的变化见下图。已知:
的选择性随压强或温度的变化见下图。已知:
![]() 的选择性
的选择性![]() ;
;
![]() 的选择性
的选择性![]()
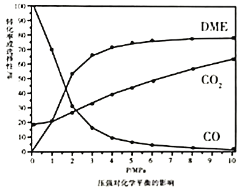
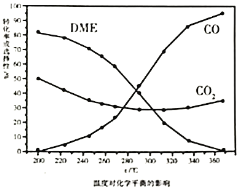
①依据图像中的数据分析,提高平衡时![]() 的选择性应当选择的条件为________。
的选择性应当选择的条件为________。
A 高温高压 B 低温低压 C 高温低压 D 低温高压
按照温度对化学平衡的影响图像分析温度低于300℃,![]() 平衡转化率随温度升高而降低的原因是_______。
平衡转化率随温度升高而降低的原因是_______。
②某温度和压强下,起始投入![]() 与足量
与足量![]() 发生反应,达到平衡时
发生反应,达到平衡时![]() 的转化率为40%,部分物质的物质的量如下表:
的转化率为40%,部分物质的物质的量如下表:
|
|
|
|
|
|
计算平衡时![]() 的选择性为________,反应Ⅳ的化学平衡常数为________。
的选择性为________,反应Ⅳ的化学平衡常数为________。
⑶经研究发现,在不同反应条件下反应相同时间(未平衡)测定发现,体系中![]() 的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
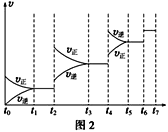
⑷![]() ,投料比为
,投料比为![]() 时进行反应,
时进行反应,![]() 的浓度随时间变化如下图所示,则下列说法正确的为________。
的浓度随时间变化如下图所示,则下列说法正确的为________。
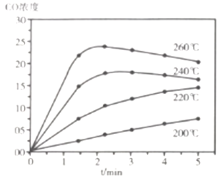
A 在![]() 范围内,反应Ⅰ的速率随温度升高而增大
范围内,反应Ⅰ的速率随温度升高而增大
B 200℃条件下,随反应时间的延长,![]() 的浓度始终增大
的浓度始终增大
C 260℃条件下,随反应时间的延长,![]() 的浓度先增大后减小最终不变
的浓度先增大后减小最终不变
D 260℃条件下,![]() 后
后![]() 的浓度减小是因为随时间推移反应Ⅱ的进行使体系中
的浓度减小是因为随时间推移反应Ⅱ的进行使体系中![]() 浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使
浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使![]() 浓度逐渐下降
浓度逐渐下降