题目内容
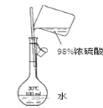
【题目】2—溴丙酸(CH3CHBrCOOH)是有机合成的重要中间体。实验室制备2—溴丙酸的反应(PCl3易潮解)、装置示意图(加热和夹持装置略去)和有关数据如下:CH3CH2COOH+Br2 → CH3CHBrCOOH+HBr
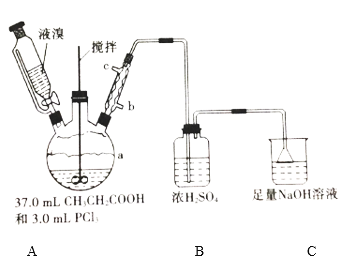
物质 | 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
Br2 | 160 | 3.1 | 58.8 | 微溶于水,易溶于有机 |
CH3CH2COOH | 74 | 0.99 | 141.1 | 易溶于水和有机溶剂 |
CH3CHBrCOOH | 153 | 1.7 | 203(分解) | 能溶于水和有机溶剂 |
请回答:
(1)检验a装置气密性的方法:盖紧滴液漏斗玻璃塞,_____________________,观察到导管口有气泡冒出,撤走热源后,导管中进入一段水柱,则证明气密性良好。
(2)按上图所示添加药品,先水浴加热a,再向a中滴加足量液溴,充分反应后,停止加热。
①a的容积最适合的是__________(填选项字母)
A.50 mL B.100 mL C.250 mL D.500 mL
②冷凝管的出水口为__________(填“b”或“c”)。
③C装置的作用为________________________________________。
(3)冷却至室温后,将a中液体减压蒸馏、纯化,收集得27.0 mL CH3CHBrCOOH。
①采用减压蒸馏的原因为_______________________________________。
②本实验的产率为_________。
(4)欲用上述装置验证a中发生取代反应,需更换B、C中的试剂。则C中应加入的试剂为____________;装置B的作用为____________。
【答案】 将B中长导管末端没入水面下,微热a(或三颈烧瓶) B c 吸收Br2和HBr,防止空气污染 降低CH3CHBrCOOH的沸点,防止CH3CHBrCOOH分解 61% (或60.6%) AgNO3溶液或石蕊溶液 除去HBr中的Br2蒸气
【解析】(1)利用热胀冷缩原理,检验a装置气密性:盖紧滴液漏斗玻璃塞,将B中长导管末端没入水面下,微热a(或三颈烧瓶),观察到导管口有气泡冒出,撤走热源后,导管中进入一段水柱,则证明气密性良好。(2)按上图所示添加药品,先水浴加热a,再向a中滴加足量液溴,充分反应后,停止加热。①a要盛40ml液体加热,容积要大于40ml的2倍,a的容积最适合的是B.100 mL;②冷凝回流液体,b处进水,冷凝管的出水口为c;③C中盛NaOH溶液与溴反应生成NaBr和NaBrO,C装置的作用为吸收Br2和HBr,防止空气污染。(3)冷却至室温后,将a中液体减压蒸馏、纯化,收集得27.0 mL CH3CHBrCOOH。①采用减压蒸馏的原因为降低CH3CHBrCOOH的沸点,防止CH3CHBrCOOH分解。②实际产量:m(CH3CHBrCOOH)=27.0 mL ×1.7g·mL-1=45.9g,理论产量:CH3CH2COOH,37.0 mL ×0.99g·mL-1=36.63g,m(CH3CHBrCOOH)=36.63g/74g·mol-1×153g·mol-1=75.735g,本实验的产率为45.9g/75.735g×100%=61%。(4)欲用上述装置验证a中发生取代反应,需更换B、C中的试剂。则C中应加入的试剂为AgNO3溶液或石蕊溶液;Br2蒸气与水作用生成HBr和HBrO,HBr也能与AgNO3溶液或石蕊溶液,装置B的作用为除去HBr中的Br2蒸气。

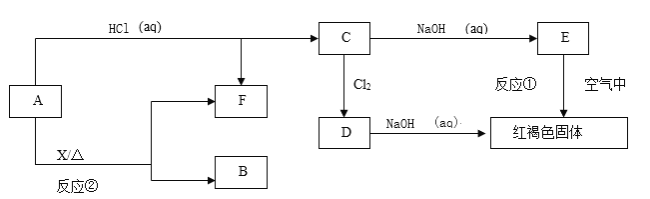
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣。粉煤灰的综合利用具有很大的价值。
(1)煤炭在火炉中燃烧很旺时,在往炉膛内的热煤炭上喷洒少量水的瞬间,炉子内火会更旺。如果烧去同量的煤炭,喷洒过水的和没有喷洒过水的煤炭相比较,它们放出的总热量___(填“相同”或“不相同”)。这是因为:________________________。
(2)研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
①以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。向分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合下表分析其原因:___________________
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~895 | 1.94~3.20 | 3.69~4.8 |
②使用碱性较弱的氨水为pH调节剂,进行分离实验。反应终点的pH对铝和铁分离效果的影响如图1。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是____________。
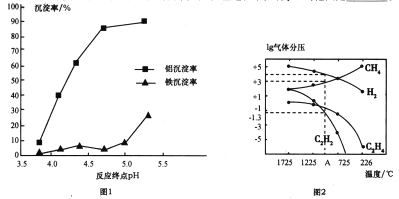
(3)工业上可利用煤的气化产物(水煤气)合成甲烷研究得出,甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图2所示。
①T℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。