题目内容
4.反应3BrF3+5H2O═HBrO3+Br2+9HF+O2↑中,氧化剂是BrF3,氧化产物是HBrO3、O2,若生成标准状况下的11.2L O2,则整个反应过程中转移电子3mol.分析 在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物,得电子化合价降低的元素被氧化.
解答 解:在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物,得电子化合价降低的元素被氧化,
所以3BrF3+5H2O→HBrO3+Br2+O2+9HF中,溴元素的化合价由+3价变为0价和+5价,氧元素的化合价由-2价变为0价,所以氧化剂是BrF3,还原剂是BrF3和H2O,氧化产物是HBrO3、O2,还原产物是Br2,被还原的元素是+3价的溴,该反应中,部分溴失电子部分得电子,水中氧元素失电子,转移电子数是6,则生成标准状况下的11.2L O2转移电子为3mol,
故答案为:BrF3;HBrO3、O2;3.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,注意三氟化溴既是氧化剂又是还原剂,为易错点,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.下列物质的应用不正确的是( )
| A. | SO2可用于漂白纸浆 | B. | 碱石灰可用于干燥氯气 | ||
| C. | 氢氟酸可用于蚀刻玻璃 | D. | 碳酸氢钠可用于中和胃酸 |
9.能用H++OH-═H2O表示的化学方程式有( )
| A. | 氢氧化钠溶液与硝酸反应 | B. | 氢氧化铁与硫酸反应 | ||
| C. | 氢氧化钡与硫酸反应 | D. | 硫酸氢钠与氢氧化钠溶液反应 |
16.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
| A. | HN3水溶液中微粒浓度大小顺序为:c(H+)>c( N3-)>c(HN3)>c(OH-) | |
| B. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c( N3-)>c(OH-)>c(H+) | |
| C. | HN3与NH3作用生成的叠氮酸铵是强电解质 | |
| D. | N3-与CO2互为等电子体 |
13.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,由于吸热反应都是非自发的 | |
| B. | 自发反应一定是熵增大,非自发反应一定是熵减少或不变 | |
| C. | 电解池的反应属于自发过程 | |
| D. | 自发反应在恰当条件下才能实现 |


 的加成类似于
的加成类似于 的加成)
的加成) .
. .
. .
. 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题: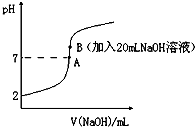 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示. 酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.