题目内容
5.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素最高正化合价与最低负化合价之和为零;考古时利用14Y测定一些文物的年代;Z是地壳中含量最高的非金属元素;Q与X同主族;R的最高价氧化物既能与稀硫酸反应,又能与氢氧化钠溶液反应.(1)Y在元素周期表中的位置为第二周期ⅣA族;
(2)五种元素原子半径由大到小的顺序是Na>Al>C>O>H(填元素符号);
(3)写出X、Z两元素形成10电子粒子的电子式
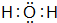 、
、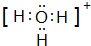 ;
;(4)Z、Q两元素形成的淡黄色固体中含有的化学键有离子键、共价键;写出该固体与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
分析 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.考古时利用14Y测定一些文物的年代,则Y为C元素;Z是地壳中含量最高的非金属元素,则Z为O元素;R的最高价氧化物既能与稀硫酸反应,又能与氢氧化钠溶液反应,则R为Al;X元素最高正化合价与最低负化合价之和为零,原子序数小于碳,则X为H元素;Q与X同主族,Q原子序数大于氧,则Q为Na,据此解答.
解答 解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.考古时利用14Y测定一些文物的年代,则Y为C元素;Z是地壳中含量最高的非金属元素,则Z为O元素;R的最高价氧化物既能与稀硫酸反应,又能与氢氧化钠溶液反应,则R为Al;X元素最高正化合价与最低负化合价之和为零,原子序数小于碳,则X为H元素;Q与X同主族,Q原子序数大于氧,则Q为Na.
(1)Y为C原子,在元素周期表中的位置为:第二周期ⅣA族,故答案为:第二周期ⅣA族;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小,故原子半径:Na>Al>C>O>H,故答案为:Na>Al>C>O>H;
(3)H、O两元素形成10电子粒子有H2O、H3O+,电子式分别为: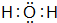 、
、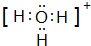 ,故答案为:
,故答案为: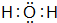 、
、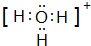 ;
;
(4)O、Na两元素形成的淡黄色固体为Na2O2,含有的化学键有:离子键、共价键,与水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:离子键、共价键;2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列化学用语使用不正确的是( )
| A. | N2的结构式 N≡N | B. | 氯化铵的电子式 | C. | S2-的结构示意图 | D. | 甲烷的比例模型  |
20.关于物质的分离、除杂方法不正确的是( )
| A. | 通过萃取、分液将乙醇和水分离 | |
| B. | 通过蒸馏将海水淡化 | |
| C. | 通过加热除去固体碳酸钠中混有的碳酸氢钠 | |
| D. | 通过溶解、过滤除去粗盐中的泥沙 |
17.在一定温度下某密闭容器中,加入1molA、3molB、2molC和2molD,发生反应:A(g)+3B(g)?2C(g)+2D(s),当下列条件成立时,能说明反应已经达到平衡状态的是( )
①A、B、C的浓度不再变化 ②v正(A)=2v逆(C)
③混合气体的压强不再变化 ④反应物的转化率不再变化
⑤A、B、C、D的分子数之比为1:3:2:2 ⑥单位时间内消耗amolA,同时生成3amolB.
①A、B、C的浓度不再变化 ②v正(A)=2v逆(C)
③混合气体的压强不再变化 ④反应物的转化率不再变化
⑤A、B、C、D的分子数之比为1:3:2:2 ⑥单位时间内消耗amolA,同时生成3amolB.
| A. | ①②③④⑤⑥ | B. | ①③④⑤⑥ | C. | ①③④⑥ | D. | ①②⑤⑥ |
14. 某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..
某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..
(1)图中a~f六中元素所形成的气态氢化物最稳定的是HF(填分子式)
(2)f在元素周期表中的位置是第三周期ⅣA族
(3)据图判断下列说法中错误的是AD
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.a、c两种元素组成的化合物中可能含有共价键
D.单质与水反应的剧烈程度:e>d>c
(4)b、c、d形成的简单离子,半径由大到小的顺序是F->Na+>Mg2+(用离子符号表示)
(5)共价键的性质通常用键长、键能等参数来描述,下表为部分非金属元素与氢元素形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长关系的一般规律同主族元素原子与相同其他原子形成的共价键,键长越短,键能越大.
 某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..
某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..(1)图中a~f六中元素所形成的气态氢化物最稳定的是HF(填分子式)
(2)f在元素周期表中的位置是第三周期ⅣA族
(3)据图判断下列说法中错误的是AD
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.a、c两种元素组成的化合物中可能含有共价键
D.单质与水反应的剧烈程度:e>d>c
(4)b、c、d形成的简单离子,半径由大到小的顺序是F->Na+>Mg2+(用离子符号表示)
(5)共价键的性质通常用键长、键能等参数来描述,下表为部分非金属元素与氢元素形成共价键的键长与键能数据:
| 共价键 | H-F | H-Cl | H-O | H-S | H-N | H-P |
| 键长(pm) | 92 | 127 | 98 | 135 | 101 | 321 |
| 键能(kJ•mol-1) | 568 | 432 | 464 | 364 | 391 | 142 |



 某课外兴趣小组进行了中和热测定实验,据此回答下列问题:用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.
某课外兴趣小组进行了中和热测定实验,据此回答下列问题:用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热. )分子的一氯代物有2种.
)分子的一氯代物有2种. 系统命名为3-甲基-2-乙基-1-丁烯
系统命名为3-甲基-2-乙基-1-丁烯 请写出其单体结构:
请写出其单体结构: 、
、 、
、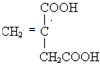 .
.