题目内容
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程。

已知:
①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为___。
(2)为提高浸出效率,锌灰在“酸浸”前可采取的措施有___;“酸浸”时,若硫酸浓度过高,可能发生副反应的化学方程式为___。
(3)“滤渣1”的主要成分为___。
(4)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为___。
(5)操作a为___、过滤、洗涤、干燥。
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
准确称取一定量的ZnSO4·7H2O晶体加入250mL的锥形瓶中,加水约20mL,再加入2-3滴5%的二甲酚橙作指示剂、约5mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160mol·L-1EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:

ZnSO4·7H2O产品的纯度为___ (保留2位有效数字)。
(7)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___。
【答案】+4 将锌灰粉碎、升高温度等 2FeO+4H2SO4=Fe2(SO4)3+SO2↑+4H2O PbSO4 3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+ 蒸发浓缩、冷却结晶 71% 2Zn2++2H2O![]() 2Zn+O2↑+4H+
2Zn+O2↑+4H+
【解析】
锌白矿(锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO) 加稀硫酸溶解,PbSO4不溶,过滤,滤渣1为PbSO4,滤液中含有硫酸锌、硫酸铜、硫酸亚铁、硫酸锰,加入锌粉发生置换反应:Zn+CuSO4═Cu+ZnSO4,滤渣为铜与过量的锌粉,滤液中再加高锰酸钾溶液、纯ZnO与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2,过滤,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4·7H2O晶体。
(1)MnO(OH)2中Mn元素的化合价为+4价。故答案为:+4;
(2)为提高浸出效率,锌灰在“酸浸”前可采取的措施有将锌灰粉碎、升高温度等;“酸浸”时,若硫酸浓度过高,FeO被氧化,可能发生副反应的化学方程式为2FeO+4H2SO4=Fe2(SO4)3+SO2↑+4H2O。故答案为:将锌灰粉碎、升高温度等;2FeO+4H2SO4=Fe2(SO4)3+SO2↑+4H2O;
(3)“酸浸”时,发生的反应有CuO+H2SO4=CuSO4+H2O;PbO+H2SO4=PbSO4+H2O;MnO+H2SO4=MnSO4 +H2O;FeO+H2SO4=FeSO4+H2O;故“滤渣1”的主要成分为PbSO4。故答案为:PbSO4;
(4)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+。故答案为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+;
(5)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。故答案为:蒸发浓缩、冷却结晶;
(6)ZnSO4·7H2O与EDTA按物质的量之比1:1反应,根据表中数据,ZnSO4·7H2O产品的纯度![]() =71%;
=71%;
故答案为:71%;
(7)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为2Zn2++2H2O![]() 2Zn+O2↑+4H+。故答案为:2Zn2++2H2O
2Zn+O2↑+4H+。故答案为:2Zn2++2H2O![]() 2Zn+O2↑+4H+。
2Zn+O2↑+4H+。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如图:
![]()
![]()
![]()
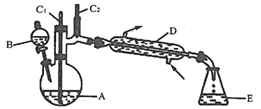
有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g·cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为___________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液时反应的离子方程式__________;
②蒸馏不能分离环己酮和水的原因是____________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是_____________;
②b中水层用乙醚萃取的目的是___________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_______,操作d中,加入NaCl固体的作用是____________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率____________。(计算结果精确到0.1%)