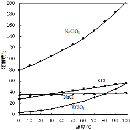
题目内容
【题目】近年来各国都在寻找对环境无害而作用快速的消毒剂,其中二氧化氯(ClO2)是目前国际上倍受瞩目的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某兴趣小组的学生设计了如下模拟装置来制取、收集ClO2并测定其质量。
查阅资料:ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。


实验Ⅰ:制取并收集ClO2,如图1装置所示。
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式__________。
(2)装置A必须添加温度控制装置,其温度要保持在60~80℃之间,控制温度的目的是__________。装置B也必须添加温度控制装置,应该是__________(填“冰水浴”或“沸水浴”或“60℃的热水浴”)装置。
实验Ⅱ:测定ClO2质量,如图2装置所示。过程如下:
在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;按照图2组装好仪器;在玻璃液封管中加入水,浸没导管口;将生成的ClO2气体由导管通入锥形瓶的溶液中充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液:用cmol/L硫代硫酸钠标准液滴定锥形瓶中的液体,共用去VmL硫代硫酸钠溶液(己知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是____________________。
(4)滴定终点的现象是____________________。
(5)测得通入ClO2的质量m(ClO2)=__________g(用整理过的含c、V的代数式表示)。
【答案】(1)2KClO3+H2C2O4![]() K2CO3+2ClO2↑+CO2↑+H2O
K2CO3+2ClO2↑+CO2↑+H2O
(2)使反应正常进行且防止温度过高引起爆炸;冰水浴
(3)吸收残余的ClO2并使锥形瓶内外压强相等
(4)当最后一滴标准溶液滴入时,溶液由蓝色变成无色,且半分钟内不恢复原色
(5)1.35CV×10-2
【解析】
试题分析:(1)潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得K2CO3、ClO2和CO2等,根据化合价升降相等和原子守恒配平,化学方程式为2KClO3+H2C2O4![]() K2CO3+2ClO2↑+CO2↑+H2O。
K2CO3+2ClO2↑+CO2↑+H2O。
(2)为了使反应正常进行且防止温度过高引起爆炸,装置A必须添加温度控制装置,其温度要保持在60~80℃之间;装置B的作用是收集熔点为-59℃,沸点为11.0℃的ClO2,所以用冰水浴进行温度控制。
(3)装置中玻璃液封管的作用是吸收残余的ClO2并使锥形瓶内外压强相等。
(4)该滴定实验用淀粉作指示剂,则滴定终点的现象是当最后一滴标准溶液滴入时,溶液由蓝色变成无色,且半分钟内不恢复原色,说明达到滴定终点。
(5)根据化学反应:8H++2ClO2+10I-=2Cl-+5I2+4H2O、I2+2S2O32-=2I-+S4O62-,得关系式:
ClO2——5S2O32—,消耗硫代硫酸钠的物质的量为CV×10-3mol,则通入ClO2的质量m(ClO2)=CV×10-3 ÷5 ×67.5g/mol=1.35CV×10-2 g.

【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
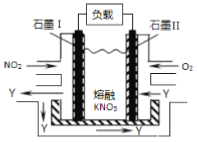
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
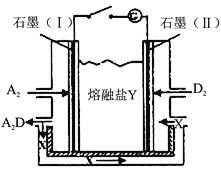
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。