题目内容
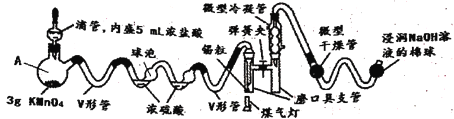
【题目】某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
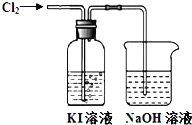
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是___。
(2)KI溶液变为黄色说明氯气具有的___性,该反应的离子方程式是___。
(3)已知I2+I-![]() I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
①实验b的目的是___。
②根据实验a中,水层中含有的粒子有___。
操作 | 实验现象 | |
a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层显浅黄色 |
b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层几近无色 |
③实验a中水溶液颜色变浅的原因是___。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为___。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化,已知1molCl2可氧化0.2molI2,该反应的化学方程式是___。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为___。
(6)溶液最终变为浅绿色的原因是___。
【答案】2NaOH+Cl2=NaCl+NaClO+H2O 氧化性 2I-+Cl2=2Cl-+I2 对比实验,证明实验a中水层显浅黄色是因为存在I2+I-![]() I3-平衡,不是单一的I2浓度降低所导致的 I2、I-、I3-、Cl-、K+ 由于萃取使水溶液中I2浓度降低,同时I2+I-
I3-平衡,不是单一的I2浓度降低所导致的 I2、I-、I3-、Cl-、K+ 由于萃取使水溶液中I2浓度降低,同时I2+I-![]() I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅 取2~3mLKI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色(或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成。或取少量实验a的水层溶液淀粉溶液,观察是否变蓝) I2+5Cl2+6H2O=10HCl+2HIO3 溶液先变蓝后褪色 氯气过量,过量的氯气溶解于水,水中含有氯气分子
I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅 取2~3mLKI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色(或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成。或取少量实验a的水层溶液淀粉溶液,观察是否变蓝) I2+5Cl2+6H2O=10HCl+2HIO3 溶液先变蓝后褪色 氯气过量,过量的氯气溶解于水,水中含有氯气分子
【解析】
氯气通入KI溶液中,氯气与碘离子反应生成单质碘,碘与溶液中的碘离子结合生成I3-(I2、I3-在水中均呈黄色),通入过量的氯气,溶液由黄色变为无色,是因为氯气将I2氧化为HIO3。
(1)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2 =NaCl+NaClO+H2O;
(2)通入氯气,KI溶液变为黄色,说明生成碘单质,说明氯气的氧化性比碘强,反应的离子方程式为2I-+Cl2=2Cl-+I2;
(3)①实验b可用与对比实验,可证明a中溶液存在I3-,说明存在I2+I-![]() I3-平衡,不是单一的I2浓度降低所导致的;
I3-平衡,不是单一的I2浓度降低所导致的;
②存在I2+I-![]() I3-平衡,则溶液中存在I2、
I3-平衡,则溶液中存在I2、![]() 、I3-,另外还含有Cl-、K+;
、I3-,另外还含有Cl-、K+;
③存在I2+I-![]() I3-平衡,溶液中存在I2,加入四氯化碳,碘易溶于四氯化碳,溶液中碘浓度降低,则I2+I-
I3-平衡,溶液中存在I2,加入四氯化碳,碘易溶于四氯化碳,溶液中碘浓度降低,则I2+I-![]() I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅;
I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅;
④为保证实验的严谨性,在实验a、b的基础上,可取2~3mLKI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色,或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成.或取少量实验a的水层溶液淀粉溶液,观察是否变蓝;
(4)氧化性Cl2>I2,KI溶液中通入氯气发生2KI+Cl2=2KCl+I2,溶液变成黄色,继续通入氯气,发生I2+5Cl2+6H2O=10HCl+2HIO3;
(5)向淀粉-KI溶液中持续通入氯气,先生成单质碘,溶液变成蓝色,继续通入氯气,碘被氧化生成HIO3,溶液褪色,故答案为:溶液先变蓝后褪色;
(6)氯气过量,过量的氯气溶解于水,水中含有氯气分子,氯水呈浅绿色。