题目内容
短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等,则( )
| A.原子半径:丙>丁>乙 |
| B.甲的气态氢化物的水溶液呈酸性 |
| C.丙与乙形成的化合物具有两性 |
| D.同周期元素中丁的最高价氧化物对应的水化物的酸性最强 |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,应位于第ⅥA族,乙与丁同族,则乙为O元素,丁为S元素,丙原子最外层电子数与电子层数相等,应为Al元素,则甲为N元素,则
A.同周期元素从左到右原子半径逐渐减小,则原子半径Al>S,同主族元素从上到下原子半径逐渐减小,则原子半径S>O,则有Al>S>O,即丙>丁>乙,故A正确;
B.甲的气态氢化物为NH3,溶液呈碱性,故B错误;
C.丙与乙形成的化合物为Al2O3,为两性氧化物,故C正确;
D.丁为S元素,位于周期表第三周期,酸性最强的应为HClO4,故D错误.
故选AC.
A.同周期元素从左到右原子半径逐渐减小,则原子半径Al>S,同主族元素从上到下原子半径逐渐减小,则原子半径S>O,则有Al>S>O,即丙>丁>乙,故A正确;
B.甲的气态氢化物为NH3,溶液呈碱性,故B错误;
C.丙与乙形成的化合物为Al2O3,为两性氧化物,故C正确;
D.丁为S元素,位于周期表第三周期,酸性最强的应为HClO4,故D错误.
故选AC.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,它们的部分化合价如下表,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 最高正价或最低负价 | -4 | +1 | +4 | -2 | -1 |
| A、乙的单质中能与水剧烈反应 |
| B、气态氢化物的稳定性:丙>甲 |
| C、丙的氧化物能与戊的氢化物水溶液反应 |
| D、其最高价氧化物对应的水化物的酸性:丁>戊 |
短周期元素甲、乙、丙、丁在元素周期表的相对位置如表所示,其中甲的气态氢化物的水溶液呈碱性,则下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 |
| A、甲位于元素周期表中第2周期、第ⅤA族 |
| B、原子半径:甲>乙 |
| C、单质的氧化性:丙>乙 |
| D、气态氢化物稳定性:丁>丙>乙 |
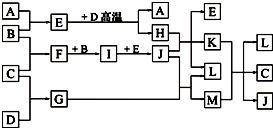 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).