题目内容
现将10mL18mol/L的H2SO4溶液溶于水配置成 500mL溶液,求:
①H2SO4溶液的物质的量浓度.
②在稀释后H2SO4溶液中投入足量金属Zn,产生氢气的体积(标准状况)
①H2SO4溶液的物质的量浓度.
②在稀释后H2SO4溶液中投入足量金属Zn,产生氢气的体积(标准状况)
分析:①根据稀释定律,稀释前后溶质的物质的量不变,据此计算稀释后硫酸的物质的量浓度;
②根据n=cV计算硫酸的物质的量,再根据方程式计算生成氢气的体积.
②根据n=cV计算硫酸的物质的量,再根据方程式计算生成氢气的体积.
解答:解:①令稀释后硫酸的浓度为cmol/L,根据稀释定律,稀释前后溶质的物质的量不变,则:
10mL×18mol/L=500mL×cmol/L
解得c=0.36,
答:稀释后硫酸的物质的量浓度为0.36mol/L.
②稀释后为稀硫酸,溶液中硫酸的物质的量=0.36mol/L×0.5L=0.18mol,Zn足量,硫酸完全反应,
令生成氢气的体积为V,则:
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.18mol V
所以V=
=4.032L,
答:生成氢气为4.032L.
10mL×18mol/L=500mL×cmol/L
解得c=0.36,
答:稀释后硫酸的物质的量浓度为0.36mol/L.
②稀释后为稀硫酸,溶液中硫酸的物质的量=0.36mol/L×0.5L=0.18mol,Zn足量,硫酸完全反应,
令生成氢气的体积为V,则:
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.18mol V
所以V=
| 22.4L×0.18mol |
| 1mol |
答:生成氢气为4.032L.
点评:本题考查物质的量浓度有关计算、根据方程式的计算,比较基础,注意理解物质的量浓度定义式并灵活运用.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
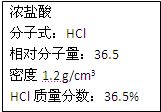 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: