题目内容
某温度下,在1L密闭容器中加入1molN2和3molH2,使之反应并达到平衡:N2(气)+3H2(气)?2NH3(气),测得平衡时N2、H2、NH3的物质的量分别为m、n、gmol,如果温度不变,只改变初始物质的加入量,而要求m、n、g总量维持不变,若N2、H2、NH3的加入量分别用x、y、z表示,则应满足条件是:
(1)若x=0,y=0,则z= mol.
(2)若x=0.75mol,则y= mol,z= mol.
(3)用数学表达式表示x、y、z应满足的条件是 和 .
(1)若x=0,y=0,则z=
(2)若x=0.75mol,则y=
(3)用数学表达式表示x、y、z应满足的条件是
考点:等效平衡
专题:化学平衡专题
分析:要求m、n、g总保持不变,则为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol来解答.
解答:
解:(1)为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,1mol氮气与3mol氢气按N2(g)+3H2(g)?2NH3(g)完全转化可以得到2mol氨气,故Z=2,
故答案为:2;
(2)为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,由N2(g)+3H2(g)?2NH3(g),则有:
0.75+0.5Z=1;
Y+1.5Z=3;
解得Z=0.5,Y=2.25;
故答案为:2.25;0.5;
(3)为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,由N2(g)+3H2(g)?2NH3(g),则有:
x+
=1 mol;
y+
=3 mol;
故答案为:x+
=1、y+
=3.
故答案为:2;
(2)为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,由N2(g)+3H2(g)?2NH3(g),则有:
0.75+0.5Z=1;
Y+1.5Z=3;
解得Z=0.5,Y=2.25;
故答案为:2.25;0.5;
(3)为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,由N2(g)+3H2(g)?2NH3(g),则有:
x+
| z |
| 2 |
y+
| 3z |
| 2 |
故答案为:x+
| z |
| 2 |
| 3z |
| 2 |
点评:本题主要考查等效平衡,掌握恒温、恒容下前后气体体积不等的可逆反应等效平衡的条件时解题的关键,难度不大.

练习册系列答案
相关题目
 25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )
25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )| A、在A点c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在B点c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、在C点c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D、在C点c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
某学生将溴乙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果未见到预期的现象,其主要原因是( )
| A、加热时间太短 |
| B、加AgNO3溶液前未用稀HNO3酸化 |
| C、应该和NaOH的乙醇溶液共热 |
| D、不应该冷却后再滴入AgNO3溶液 |
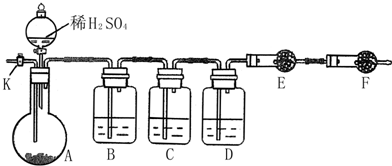 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)