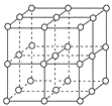
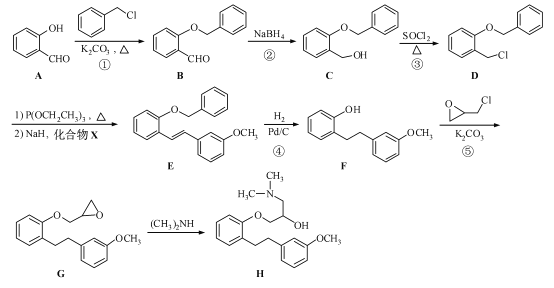
题目内容
【题目】炭粉与![]() 反应的产物比较复杂,某化学研究小组在实验室中以炭粉与
反应的产物比较复杂,某化学研究小组在实验室中以炭粉与![]() 反应为探究对象,拟通过实验探究反应后的产物,提出如下4种猜想:
反应为探究对象,拟通过实验探究反应后的产物,提出如下4种猜想:
猜想1:反应后产物是![]()
猜想2:反应后产物是![]() 和CO
和CO
猜想3:反应后产物是![]() 和
和![]()
猜想4:反应后产物是![]() 和
和![]()
(1)实验前,小组成员经过讨论认定猜想3不成立,理由是______。
(2)实验过程:已知:湿润的氯化钯试纸遇CO变黑,可用于检验是否有CO生成,针对猜想1、2、4,设计如图所示的实验装置:
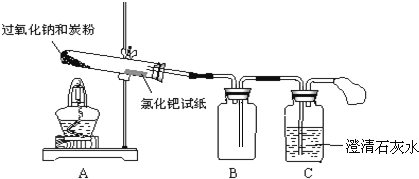
![]() 根据上图连接好实验装置,并检查气密性。
根据上图连接好实验装置,并检查气密性。
![]() 将
将![]() 炭粉与
炭粉与![]() 均匀混合装入试管,在靠近试管口处放置一张湿润的氯化钯试纸。
均匀混合装入试管,在靠近试管口处放置一张湿润的氯化钯试纸。
![]() 用酒精灯微微加热试管底部。
用酒精灯微微加热试管底部。
![]() 试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,澄清石灰水未变浑浊。
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,澄清石灰水未变浑浊。
其中装置B的作用是______;由此可推测猜想______不成立。若CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。
(3)结果分析讨论:
试管冷却至室温、称量、测得剩余固体的质量为![]() ,由此可初步确认猜想______是正确的,炭粉与
,由此可初步确认猜想______是正确的,炭粉与![]() 反应的化学方程式为______。请你设计实验验证上述猜想4,完成下表中内容。
反应的化学方程式为______。请你设计实验验证上述猜想4,完成下表中内容。![]() 可供选择的药品有
可供选择的药品有![]() 溶液、酚酞溶液、盐酸等
溶液、酚酞溶液、盐酸等![]()
实验方案 | 预期实验结果和结论 |
____________ | ____________ |
【答案】氧化钠能与二氧化碳反应生成碳酸钠 作安全瓶,防止倒吸 2 ![]() 1或4
1或4  加水溶解,再加入足量的氯化钡溶液,滴入几滴酚酞溶液 若溶液变红色,说明猜想成立
加水溶解,再加入足量的氯化钡溶液,滴入几滴酚酞溶液 若溶液变红色,说明猜想成立
【解析】
(1)猜想3中![]() 和CO能发生反应,故不成立;
和CO能发生反应,故不成立;
(2)过氧化钠和炭粉加热反应,湿润的氯化钯试纸没有变黑,说明没有CO生成,猜想2不成立,B是安全瓶,起防止倒吸的作用。用C中的石灰水检验是否有CO2生成。
(3)试管冷却至室温、称量、测得剩余固体的质量为![]() ,和加入的过氧化钠和炭粉的总质量相等,说明没有气体生成,由此可初步确认猜想1或4是正确的,根据原子守恒,炭粉与
,和加入的过氧化钠和炭粉的总质量相等,说明没有气体生成,由此可初步确认猜想1或4是正确的,根据原子守恒,炭粉与![]() 反应不能只生成Na2CO3,还必须有Na2O生成,可写出反应的化学方程式。设计实验验证上述猜想4,只需证明有Na2O即可。利用Na2O和水反应生成NaOH检验。
反应不能只生成Na2CO3,还必须有Na2O生成,可写出反应的化学方程式。设计实验验证上述猜想4,只需证明有Na2O即可。利用Na2O和水反应生成NaOH检验。
![]() 由于氧化钠能与二氧化碳反应生成碳酸钠,故猜想3不成立,
由于氧化钠能与二氧化碳反应生成碳酸钠,故猜想3不成立,
故答案为:氧化钠能与二氧化碳反应生成碳酸钠;
![]() 若生成二氧化碳被石灰水吸收,容易产生倒吸的危险,装置B的作用是作安全瓶,防止倒吸;氯化钯试纸未变黑,澄清石灰水未变浑浊,说明没有CO、
若生成二氧化碳被石灰水吸收,容易产生倒吸的危险,装置B的作用是作安全瓶,防止倒吸;氯化钯试纸未变黑,澄清石灰水未变浑浊,说明没有CO、![]() 生成,由此可推测猜想2不成立,CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯
生成,由此可推测猜想2不成立,CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯![]() ,CO氧化生成二氧化碳,还有HCl生成,反应方程式为:
,CO氧化生成二氧化碳,还有HCl生成,反应方程式为:![]() ,
,
故答案为:作安全瓶,防止倒吸;2;![]() ;
;
![]() 剩余固体的质量为
剩余固体的质量为![]() ,等于反应物总质量,说明没有气体生成,初步确认猜想1或4成立,根据原子守恒可知,不能只生成
,等于反应物总质量,说明没有气体生成,初步确认猜想1或4成立,根据原子守恒可知,不能只生成![]() ,还有氧化钠生成,反应方程式为:
,还有氧化钠生成,反应方程式为: ;
;
设计实验验证猜想4:将反应后的物质溶于水,再加入足量的氯化钡溶液,滴入几滴酚酞溶液,若溶液变红色,说明猜想成立,
故答案为:1或4; ;
;
实验方案 | 预期实验结果和结论 |
加水溶解,再入足量的氯化钡溶液,滴入几滴酚酞溶液 | 若溶液变红色,说明猜想成立 |

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案