题目内容
等质量的CaCO3和MgO粉末分别溶于相同体积的硝酸中,得到的Ca(NO3)2和Mg(NO3)2的物质的量浓度分别为a mol?L-1和b mol?L-1.则a与b的关系为( )
| A、5a=2b |
| B、2a=5b |
| C、3a=2b |
| D、2a=3b |
考点:化学方程式的有关计算
专题:
分析:设它们的质量都是100g,则利用n=
来计算物质的量,再由原子守恒来分析Ca(NO3)2和Mg(NO3)2的物质的量,因溶液体积相同,则溶质的物质的量的比值等于浓度之比.
| m |
| M |
解答:
解:因碳酸钙的摩尔质量为100g/mol,设CaCO3和MgO粉末的质量均为100g,
则n(CaCO3)=
=1mol,n(MgO)=
=2.5mol,
由原子守恒可知CaCO3~Ca(NO3)2,MgO~Mg(NO3)2,
则Cu(NO3)2和Mg(NO3)2的物质的量分别为1mol、2.5mol,
因溶液体积相同,则溶质的物质的量的比值等于浓度之比,
a:b=1mol:2.5mol=2:5,
即5a=2b,
故选A.
则n(CaCO3)=
| 100g |
| 100g/mol |
| 100g |
| 40g/mol |
由原子守恒可知CaCO3~Ca(NO3)2,MgO~Mg(NO3)2,
则Cu(NO3)2和Mg(NO3)2的物质的量分别为1mol、2.5mol,
因溶液体积相同,则溶质的物质的量的比值等于浓度之比,
a:b=1mol:2.5mol=2:5,
即5a=2b,
故选A.
点评:本题考查金属化合物与硝酸的反应,明确金属与盐的关系及巧设氧化物的质量是快速解答本题的关键,并学会利用守恒法来分析问题,题目难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
Cu+Cl2
CuCl2的反应类型属于( )
| ||
| A、置换反应 | B、分解反应 |
| C、化合反应 | D、复分解反应 |
关于强、弱电解质叙述正确的是( )?
| A、强电解质都是离子化合物,弱电解质都是共价化合物? |
| B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物? |
| C、强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子? |
| D、强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱? |
下列物质属于非电解质的是( )
| A、C2H5OH |
| B、NaOH |
| C、NaCl |
| D、H2SO4 |
下列关于离子的检验说法正确的是( )
| A、向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- |
| B、向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- |
| C、向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的红色石蕊试纸靠近试管口,若试纸不变蓝,则说明该溶液中无NH4+ |
| D、如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
下列分子中的中心原子采取sp2杂化的是( )
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥BeCl2⑦SO3 ⑧BF3.
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥BeCl2⑦SO3 ⑧BF3.
| A、①②⑥⑦ | B、③⑤⑦⑧ |
| C、①③⑦⑧ | D、③⑤⑥⑦ |
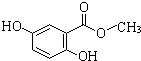
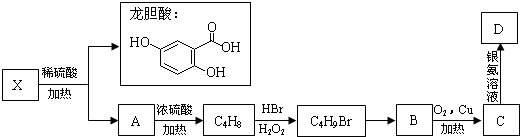
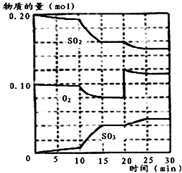 已知一定条件下在1L的密封容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H<0,反应过程中SO2、O2、SO3物质的量变化如图,请根据图示回答下列问题:
已知一定条件下在1L的密封容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H<0,反应过程中SO2、O2、SO3物质的量变化如图,请根据图示回答下列问题: