题目内容
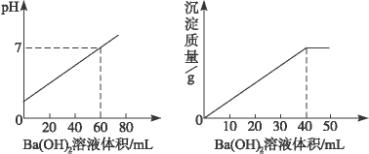
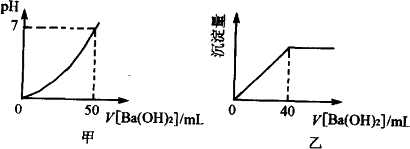
用0.05 mol·L-1的Ba(OH)2溶液,滴定盐酸和硫酸的混合液,下图分别是Ba(OH)2溶液加入量和pH以及沉淀量的关系,求原混合液中H+、Cl-、![]() 的物质的量浓度.
的物质的量浓度.
答案:
解析:
解析:
|
由图甲看,滴入Ba(OH)2前混酸pH=0,所以c(H+)=1 mol·L-1.由图像可知,加入50 mL Ba(OH)2溶液,恰好将混酸完全中和.设混酸体积为x,则有1 mol·L-1·x=0.05 mol·L-1×2×0.05 L,x=0.005 L.由图乙可知,滴入Ba(OH)2 40 mL,将混酸中 c( c(HCl)= 所以原混合液中c(H+)、c(Cl-)、c( |

练习册系列答案
相关题目