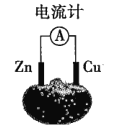
题目内容
【题目】在容积为1 L的密闭容器中,将CO和水蒸气的混合气体加热到800 ℃时,有下列平衡CO(g)+H2O(g)![]() CO2(g)+H2(g),且K=1,若用2 mol CO和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率为( )
CO2(g)+H2(g),且K=1,若用2 mol CO和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率为( )
A.16.7%B.50%C.66.7%D.83.3%
【答案】D
【解析】
在密闭容器中将CO和水蒸气的混合物加热到800℃时,达到平衡状态,设消耗一氧化碳物质的量为x:
CO + H2O CO2 + H2,
起始量(mol) 2 10 0 0
变化量(mol) x x x x
平衡量(mol)2-x 10-x x x
反应前后气体物质的量不变,可以利用气体物质的量代替平衡浓度计算平衡常数平衡常数K=![]() =1.x=
=1.x=![]() mol,则CO的转化率=
mol,则CO的转化率=![]() ×100%=83.3%;
×100%=83.3%;
答案选D。

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%