题目内容
常温下,浓度均为0.1000 mol / L的三种一元酸HX、HY、HZ,分别用0. 1000 mol/ L的NaOH溶液进行滴定,滴定曲线如图所示。下列有关叙述正确的是
| A.NaOH溶液与三种酸的反应均是吸热反应 |
| B.滴定酸HY可用酚酞作指示剂 |
| C.酸性强弱:HX>HY>HZ |
| D.滴定三种酸都可用甲基橙作指示剂 |
B
解析试题分析:A.酸碱中和反应都是放热反应。错误。B.酸碱中和滴定选择指示剂时,为了减小实验误差,应该选择的指示剂的颜色变化由浅到深的为好。由于是用碱滴定酸,所以可用酚酞作指示剂。正确。C. 当酸的浓度相同时,酸越容易电离,则溶液中c(H+)越大,溶液的pH就越小。所以酸性HZ>HY>HX。错误。D. 滴定三种酸若都用甲基橙作指示剂,溶液的颜色变化是由红色变为橙色。颜色由深到浅。实验误差相对较大。应该用酚酞作指示剂为好。错误。
考点:考查酸碱中和滴定的指示剂的选择、反应热、酸性强弱的比较的知识。

练习册系列答案
相关题目
某温度下,已知醋酸的电离常数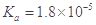 ,醋酸银的溶度积
,醋酸银的溶度积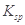 (CH3COOAg )=1.6×10
(CH3COOAg )=1.6×10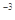 ,
,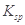 (Ag2CO3)="8.3"
(Ag2CO3)="8.3" 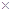 l0
l0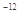 。在不考虑盐类水解的情况下,下列有关说法正确的是
。在不考虑盐类水解的情况下,下列有关说法正确的是
A.醋酸水溶液中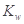 不变,故醋酸对水的电离无影响 不变,故醋酸对水的电离无影响 |
| B.该温度下饱和醋酸水溶液的pH =5-lgl.8 |
C.该温度下浓度均为0.01 mol 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成 |
D.将0.02 mol 的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀 的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀 |
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是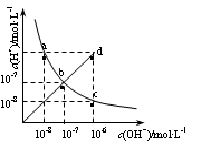
| A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14 |
| B.b d线段上任意一点对应的溶液都呈中性 |
| C.d点对应溶液的温度高于25℃,pH<7 |
| D.CH3COONa溶液不可能位于c点 |
用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1~4.4)。下列判断正确的是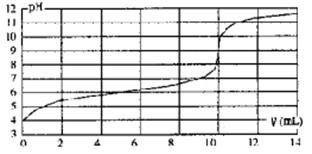
| A.HA的浓度为l×10-4mol·L-1 |
| B.实验时可选甲基橙作指示剂 |
| C.V=10mL,酸碱恰好中和 |
| D.pH=7时,溶液中c(Na+)>c(A-) |
25℃时,水中存在电离平衡:H2O H++OH-。下列关于水的说法,不正确的是( )
H++OH-。下列关于水的说法,不正确的是( )
| A.水的电离是吸热过程 |
| B.向水中加入少量稀硫酸,c(H+)增大,KW不变 |
| C.含H+的溶液显酸性,含OH-的溶液显碱性 |
| D.水是极弱的电解质,在50℃时水的pH小于7 |
下列电离方程式的书写正确的是 ( )
A.NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
B.S2-+2H2O H2S+2OH- H2S+2OH- |
C.CH3COOH+H2O CH3COO-+H3O+ CH3COO-+H3O+ |
D.CH3COOH+OH- CH3COO-+H2O CH3COO-+H2O |
物质的量浓度相等的4种溶液:①H2S、②NaHS、③Na2S、④H2S和NaHS的混合液。下列说法正确的是( )
| A.溶液pH由大到小的顺序:③>②>①>④ |
| B.c(H2S)由大到小的顺序:①>④>②>③ |
| C.在Na2S溶液中:2c(Na+)=c(H2S)+c(HS-)+c(S2-) |
| D.在NaHS溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) |

