题目内容
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则原混合气体中NO的物质的量为 ( )
| A.0.3mol | B.0.4mol | C.0.5mol | D. 0.6mol |
A
解析试题分析:n(Cu)=51.2g÷64g/mol=0.8mol.在反应过程中失去电子1.2mol.产生的气体被吸收得到NaNO3和NaNO2中n(Na):n(N)1:1.n(Na)=n(NaOH)=0.5L×2mol/L=1mol.结合氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,可得你(N2O4)=0.2mol假设NO、NO2的物质的量分别为X、Y根据原子守恒可得X+Y=0.6.根据电子守恒可得:3X+Y+0.2×2=0.8×2.解得X=0.3;Y=0.3.选项为:A.
考点:考查氧化还原反应中的电子守恒和原子守恒的知识。

练习册系列答案
相关题目
下列溶液中能够区别SO2和CO2气体的是
①澄清石灰水 ②KMnO4酸性溶液 ③氯水 ④品红溶液
| A.①③④ | B.②③④ | C.①②③ | D.全部 |
用图所示装置进行实验,下列对实验现象的解释不合理的是( )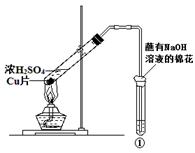
| | ①中试剂 | ①中现象 | 解 释 |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
下列说法正确的是( )
| A.1 mol Cl2参加反应转移电子数一定为2NA |
| B.在反应KClO3+6HCl=KCl+3Cl2+3H2O中,每生成3 mol Cl2转移电子数为6NA |
| C.SiO2与烧碱反应只生成盐和水,属于酸性氧化物 |
| D.Cl2的水溶液具有酸性,Cl2通入紫色石蕊溶液中,溶液只变红 |
某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的NO气体在标准状况下的体积为( )
| A.36L | B.28L | C.22.4L | D.11.2L |
在下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.Ba(NO3)2 | C.Na2S | D.BaCl2 |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。若该气体为无色气体,且通过品红溶液后,品红溶液褪色,剩余气体与空气接触时,很快变为红棕色。下列判断正确的是
| A.肯定只有NO |
| B.肯定有SO2和O2 |
| C.可能有Cl2和O2 |
| D.肯定没有Cl2、O2和NO2 |

