题目内容
【题目】三氟化氮(NF3)常用于微电子工业,可用以下反应制备:4NH3+3F2=NF3+3NH4F,下列说法中,正确的是( )
A.NF3的电子式为![]()
B.NH4F分子中仅含离子键
C.在制备NF3的反应中,NH3表现出还原性
D.在制备NF3的反应方程式中,各物质均为共价化合物
【答案】C
【解析】
A.NF3为共价化合物,但F原子外围还有3对孤对电子,则NF3的电子式为 ,故A错误;
,故A错误;
B.NH4F中铵根与氟离子之间为离子键,而铵根内还含有共价键,故B错误;
C.该反应中NH3→NF3氮元素的化合价由-3价→+3价,所以氨气作还原剂表现出还原性,故C正确;
D.NH4F中铵根与氟离子之间为离子键,所以NH4F是离子化合物,故D错误;
故答案为C。

【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO | 正确;Mg(OH)2比MgCO3更难溶 |
C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO | 正确;H2SO3的酸性强于HClO |
D | 将Na2O2固体溶于水:2Na2O2+2H2O=4Na++4OH-+O2↑ | 正确; Na2O2是碱性氧化物 |
A.AB.BC.CD.D
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________________。
(3)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为____________
(4)PO43-的中心原子的杂化方式为__________,键角为_______________
(5)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________
(6)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
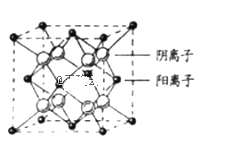
(7)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_____________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为___________________g·cm-3(不必化简)。
【题目】A、B、C、D四种易溶于水的化合物只由表中的八种离子组成,且四种化合物中阴、阳离子各不相同。
阴离子 | Cl-、SiO32-、OH-、NO3- |
阳离子 | H+、Ag+、Na+、K+ |
已知:A溶液呈强酸性,且A溶液与B、C溶液混合均产生白色沉淀,B的焰色反应呈黄色。
回答下列问题:
(1)写出A、B、C、D的化学式:A______,B_____,C____,D____。
(2)写出A溶液与B溶液反应的离子方程式: __________。
(3)请选出适合存放A、C、D溶液的试剂瓶的序号:

溶液 | A | C | D |
试剂瓶序号 | ___ | ___ | ___ |