题目内容
12.有关实验操作正确的是( )| A. | 加热蒸发皿时垫上石棉网 | B. | 将氢氧化钠固体放入烧杯中称量 | ||
| C. | 在量筒中溶解氯化钠固体 | D. | 将pH试纸浸入待测液中测定pH |
分析 A、蒸发皿可以直接受热;
B、氢氧化钠易潮解;
C、量筒不能用于溶解固体;
D、将pH试纸浸入待测液中会污染溶液.
解答 解:A、蒸发皿可以直接受热,不用垫石棉网,故A错误;
B、氢氧化钠易潮解,故不能放在纸上称量,只能放在小烧杯中,故B正确;
C、量筒不能用于溶解固体,故氯化钠固体的溶解应放在烧杯中进行,故C错误;
D、将pH试纸浸入待测液中会污染溶液,故应将pH试纸放在玻璃片上,然后用玻璃棒蘸取待测液点在试纸的中部,然后与比色卡做比对,故D错误.
故选B.
点评 本题考查了试剂的称量方法和仪器的使用,难度不大,应注意的是pH试纸的使用方法.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 1mol任何气体的体积都是22.4L | |
| B. | 1mol H2的质量是1g,它所占的体积是22.4L | |
| C. | 在标准状况下,1mol任何气体所占的体积都约为22.4L•mol-1 | |
| D. | 在标准状况下,1mol任何气体所占的体积都约为22.4L |
20.已知Iˉ、Fe2+、SO2、Clˉ、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Clˉ<Fe2+<H2O2<Iˉ<SO2.则下列反应不能发生的是( )
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42ˉ+4H+ | B. | Cl2+SO2+2H2O=H2SO4+2HCl | ||
| C. | H2O2+2H++SO42ˉ=SO2↑+O2↑+2H2O | D. | 2Iˉ+2H++H2O2=2H2O+I2 |
17.下列反应的离子方程式的书写正确的是( )
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氯化铝溶液与过量氨水反应:Al3++3OH-=Al(OH)3↓ |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol•L-1的NaCl 溶液中含有Cl-的数目为NA | |
| B. | 78g 苯含有C=C双键的数目为3NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
1.下列说法正确的是( )
| A. | 邻二甲苯苯环上的一氯取代产物有4种 | |
| B. | 甲基丙烯酸和甲酸丙酯互为同分异构体 | |
| C. | 乙二醇与甘油互为同系物 | |
| D. | 含5个碳原子的有机物,每个分子中最多可形成5个C-C单键 |
4.目前,由化学能转变为热能或电能仍是人类使用的最主要能源.
I.氢气是一种很有前途的新能源,以水为原料大量制取氢气的最理想途径是a.
a.利用太阳能直接将水分解产生氢气 b.以焦炭和水制取水煤气后分离出氢气
c.用Fe跟HCl反应放出氢气 d.由热电站提供电力电解水产生氢气
II.下表列出了断裂1mol某些化学键所需的能量
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,回答下列问题:
(1)该反应属于_放热(填“放热”或“吸热”)反应,1mol H2(g)和0.5molO2(g)的总能量大于(填“大于”“小于”或“等于”) 1mol H2O(g)的总能量,此反应中化学能主要转化为热能.
(2)表中a=496.4 kJ.
(3)若H2O(l)═H2O(g)△H=+44kJ•mol-1
请写出H2(g)燃烧生成液态水时的热化学方程式_H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1.
I.氢气是一种很有前途的新能源,以水为原料大量制取氢气的最理想途径是a.
a.利用太阳能直接将水分解产生氢气 b.以焦炭和水制取水煤气后分离出氢气
c.用Fe跟HCl反应放出氢气 d.由热电站提供电力电解水产生氢气
II.下表列出了断裂1mol某些化学键所需的能量
| 化学键 | H-H | O=O | O-H |
| 能量(kJ) | 436 | a | 463 |
(1)该反应属于_放热(填“放热”或“吸热”)反应,1mol H2(g)和0.5molO2(g)的总能量大于(填“大于”“小于”或“等于”) 1mol H2O(g)的总能量,此反应中化学能主要转化为热能.
(2)表中a=496.4 kJ.
(3)若H2O(l)═H2O(g)△H=+44kJ•mol-1
请写出H2(g)燃烧生成液态水时的热化学方程式_H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1.
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验: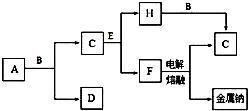 中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).