题目内容
①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L?1.25 mol·L-1的盐酸中,②将0.100 L? 1.25 mol·L-1的盐酸逐滴滴入0.100 L 1.00 mol·L-1的纯碱溶液中。两种操作产生CO2的体积比为( )A.5∶2 B.2∶5? C.2∶1 D.1∶1?
解析:纯碱与盐酸反应时,操作顺序不同反应进程也不同。?
操作①:纯碱滴入盐酸中,发生反应:?
Na2CO3+2HCl![]() 2NaCl+CO2↑+H2O
2NaCl+CO2↑+H2O
生成的CO2与盐酸用量有关:?
n(CO2)=![]() n (HCl)=
n (HCl)= ![]() ×
×
操作②:盐酸滴入纯碱中,发生反应:?
Na2CO3+HCl![]() NaCl+NaHCO3①?
NaCl+NaHCO3①?
NaHCO3+HCl![]() NaCl+CO2↑+H2O②?
NaCl+CO2↑+H2O②?
则反应①消耗盐酸:?
生成0.100 mol NaHCO3,过量盐酸 (0.025 0 mol)与NaHCO3反应生成0.025 0 mol CO2。所以:
n①(CO2)∶n②(CO2)=0.062 5 mol∶0.025 0 mol=5∶2。?
答案:A?

练习册系列答案
相关题目
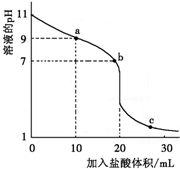 室温下,将0.100 0mol?L-1盐酸滴入20.00mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.100 0mol?L-1盐酸滴入20.00mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )