题目内容
氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化.从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式).
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为: .
(3)析出CuCl晶体时的最佳pH在 左右.

(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的目的是 .
(5)从滤液A中可回收的主要物质是 (写化学式).
(6)以碳棒为电极电解CuCl2溶液可得到CuCl.写出电解CuCl2溶液后的阴极上发生的反应为 .

请回答下列问题:
(1)电镀污泥的主要成分是
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
(3)析出CuCl晶体时的最佳pH在

(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的目的是
(5)从滤液A中可回收的主要物质是
(6)以碳棒为电极电解CuCl2溶液可得到CuCl.写出电解CuCl2溶液后的阴极上发生的反应为
考点:金属的回收与环境、资源保护,电解原理,铜金属及其重要化合物的主要性质
专题:电化学专题,几种重要的金属及其化合物
分析:电镀废液中加入碱可生成Cu(OH)2、Fe(OH)3沉淀,在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得滤液为硫酸亚铁,结合CuCl的性质和题目要求解答该题.
解答:
解:(1)电镀废液主要含Cu2+、Fe3+,加入碱可生成Cu(OH)2、Fe(OH)3沉淀,
故答案为:Cu(OH)2、Fe(OH)3;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,
故答案为:3;
(4)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(5)由框图分析可知:滤液A中主要物质是Na2SO4和FeSO4,
故答案为:Na2SO4和FeSO4;
(6)电解CuCl2溶液时,阴极上发生的反应为Cu2+得到电子生成+1价铜,
故答案为:Cu2++Cl-+e-═CuCl↓
故答案为:Cu(OH)2、Fe(OH)3;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,
故答案为:3;
(4)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(5)由框图分析可知:滤液A中主要物质是Na2SO4和FeSO4,
故答案为:Na2SO4和FeSO4;
(6)电解CuCl2溶液时,阴极上发生的反应为Cu2+得到电子生成+1价铜,
故答案为:Cu2++Cl-+e-═CuCl↓
点评:本题考查制备方案的设计,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,答题时注意审题,把握自学能力的培养,难度中等.

练习册系列答案
相关题目
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
A、异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
| B、邻羟基苯甲酸与NaHCO3溶液反应 |
| C、甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 |
| D、2-氯丁烷与NaOH乙醇溶液共热发生消去反应 |
下列反应的离子方程式正确的是( )
A、乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-
| ||
B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||
| C、苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | ||
D、乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH-
|
下列各组物质仅用蒸馏水不能鉴别出的是( )
| A、苯、酒精、硝基苯 |
| B、氧化铜、二氧化锰、活性碳 |
| C、食盐、烧碱、硝酸铵 |
| D、蔗糖、硫酸铜粉末、碳酸钙粉末 |
将一定质量的铁、铜组成的混合物9.90g加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入6mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加到17.55g,则下列叙述中正确的是( )
| A、当金属全部溶解时收集到NO气体的体积为3.36L |
| B、当金属全部溶解时,无法计算参加反应的硝酸的物质的量 |
| C、将生成的沉淀加热灼烧,可能得到FeO、Fe2O3和CuO的混合物 |
| D、当生成沉淀达到最大量时,消耗NaOH溶液的体积为V≥75ml |
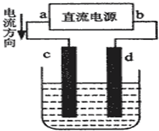 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、电解过程中,c电极发生还原反应 |
| C、电解过程中,d电极质量增加 |
| D、电解过程中,氯离子浓度不变 |
 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A、常压下五种元素的单质中,Z单质的熔点最高 |
| B、Z2水溶液中通入YO2后褪色,表现了YO2的漂白性 |
| C、工业上合成X的氢化物采用高温高压催化剂条件 |
| D、Y、Z的阴离子电子层结构都与R原子的相同 |