题目内容
1.短周期的四种元素X、Y、Z、W,原子序数依次增大,X、Y、Z的最外层电子数分别是其电子层数的1、2、3倍,W的电子层数是其最外层电子数的3倍;X可以分别和Z、W形成原子个数比都为1:1的化合物甲和乙,其中甲为共价化合物,乙为离子化合物.请回答:(1)化合物乙的电子式是Na+[:H]-;
(2)实验室中可以在甲的30%的水溶液加入一种黑色粉末状固体制取Z元素的常见单质;写出该反应的化学方程式2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$ 2 H2O+O2↑;
(3)Y和Z两种元素可构成一种化合物丙,其水溶液呈酸性;试用恰当的方程式表示该溶液呈酸性的原因CO2+H2O=H2CO3、H2CO3?H++HCO3-;
(4)在由X、Z和W三种元素构成的化合物的溶液中,加入(或通入)过量丙,恰好完全反应后,所得溶液中除H2O、H+和OH-三种微粒外,存在的微粒还有(请用微粒符号按浓度由大到小的顺序以“>”连接填写)Na+>HCO3->H2CO3>CO32-;
(5)由四种元素构成的一种分子组成为X3Y2Z2W的离子化合物易溶于水,则该物质的溶液的pH>7(填“>”、“<”或“=”),其原因是CH3COO-+H2O?CH3COOH+OH-.
分析 短周期的四种元素X、Y、Z、W,原子序数依次增大,W的电子层数是其最外层电子数的3倍,最外层电子数只能为1,电子层为3,故A为Na;由原子序数可知,Y、Z处于第二周期,Y、Z的最外层电子数分别是其电子层数的2、3倍,则最外层电子数分别为4、6,故Y为C元素、Z为O元素;X原子序数小于碳,最外层电子数与电子层数相等,X为H或Be,X可以分别和O、Na形成原子个数比都为1:1的化合物甲和乙,其中甲为共价化合物,乙为离子化合物,则X为H元素,甲为H2O2,乙为NaH,据此解答.
解答 解:短周期的四种元素X、Y、Z、W,原子序数依次增大,W的电子层数是其最外层电子数的3倍,最外层电子数只能为1,电子层为3,故A为Na;由原子序数可知,Y、Z处于第二周期,Y、Z的最外层电子数分别是其电子层数的2、3倍,则最外层电子数分别为4、6,故Y为C元素、Z为O元素;X原子序数小于碳,最外层电子数与电子层数相等,X为H或Be,X可以分别和O、Na形成原子个数比都为1:1的化合物甲和乙,其中甲为共价化合物,乙为离子化合物,则X为H元素,甲为H2O2,乙为NaH.
(1)化合物乙为NaH,电子式是:Na+[:H]-,故答案为:Na+[:H]-;
(2)实验室中可以在H2O2的30%的水溶液加入一种黑色粉末状固体制取氧气,反应方程式为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$ 2 H2O+O2↑,
故答案为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$ 2 H2O+O2↑;
(3)C和O两种元素可构成一种化合物丙,其水溶液呈酸性,该化合物为CO2,用恰当的方程式表示该溶液呈酸性的原因为:CO2+H2O=H2CO3、H2CO3?H++HCO3-,
故答案为:CO2+H2O=H2CO3、H2CO3?H++HCO3-;
(4)在由H、O和Na三种元素构成的化合物为NaOH,向NaOH溶液中,加入(或通入)过量CO2,恰好完全反应后生成NaHCO3,溶液中碳酸氢根生成程度大于电离程度,溶液呈碱性,所得溶液中除H2O、H+和OH-三种微粒外,存在其它的微粒按浓度由大到小排序:Na+>HCO3->H2CO3>CO32-,
故答案为:Na+>HCO3->H2CO3>CO32-;
(5)由四种元素构成的一种分子组成为H3C2O2Na的离子化合物易溶于水,该化合物为CH3COONa,溶液中存在:CH3COO-+H2O?CH3COOH+OH-,其溶液pH>7,
故答案为:>;CH3COO-+H2O?CH3COOH+OH-.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,是对学生综合能力的考查,难度中等.

| A. | 元素周期表中一共有16个纵行 | |
| B. | 除零族元素外,非金属元素全都是主族元素 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
| A. | 液氟的气化和液溴的气化 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
| A. | 铁跟盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 磷酸二氢钙溶液跟氢氧化钙溶液反应 H2PO4-+2OH-═PO43-+2H2O | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 铜片跟稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
| A. | Na+、Al3+、Cl-、OH-(5:2:7:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、HCO3-(1:1:1:1) |
 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )| A. | 该有机玻璃的化学名称为聚甲基丙烯酸甲酯 | |
| B. | 该有机玻璃可用2-甲基-丙烯酸和甲醇为原料,通过酯化反应、加聚反应制得 | |
| C. | 等物质的量的有机玻璃和2-甲基-丙烯酸甲酯耗氧量相同 | |
| D. | 其在一定条件下发生水解反应时,可得到另外一种高分子化合物 |
| X | Y | Z | M |
| R | W |
 .
.(2)比较Z、W的简单氢化物沸点高低并说明原因沸点H2O>H2S,由于H2O分子之间存在氢键.
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%,则化合物甲的化学式为N4S4.
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无极高分子混凝剂,净水剂,实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
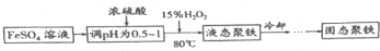
(4)FeSO4溶液显弱酸性的原因是Fe2++2H2O?2H++Fe(OH)2(用离子方程式表示)
(5)加入浓硫酸调节pH的作用是:①抑制Fe2+水解;②提高H2O2的氧化能力(或促进Fe2+被氧化).
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4.
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.此过程发生的部分反应为:
Sn2++2Hg2++8Cl-═Hg2Cl2↓+SnCI62-
Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差.
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗K2Cr2O7标准溶液12.80mL,则聚铁中铁元素的质量分数为21.5%.
| A. | Al(OH)3 | B. | Na[Al (OH)4] | C. | FeCl2 | D. | Na2O2 |