题目内容
100mL 0.3mol/L的NaCl溶液与500mL 0.1mol/L的AlCl3溶液中Cl-的浓度之比为( )
| A、1:1 | B、3:1 |
| C、3:5 | D、1:5 |
考点:物质的量浓度的相关计算
专题:
分析:离子的物质的量浓度与溶液体积大小无关,.3mol/L的NaCl和0.1mol/L的AlCl3溶液中Cl-的浓度都是0.3mol/L.
解答:
解:100mL 0.3mol/L的NaCl溶液中氯离子的物质的量浓度为:0.3mol/L,
500mL 0.1mol/L的AlCl3溶液中Cl-的浓度为:0.1mol/L×3=0.3mol/L,
所以两溶液中氯离子浓度之比为1:1,
故选A.
500mL 0.1mol/L的AlCl3溶液中Cl-的浓度为:0.1mol/L×3=0.3mol/L,
所以两溶液中氯离子浓度之比为1:1,
故选A.
点评:本题考查了物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,明确物质的量浓度概念及表达式即可解答,注意离子浓度与溶液体积大小无关,与溶质的化学式组成、浓度有关.

练习册系列答案
相关题目
下列各组有机物中,不能用酸性高锰酸钾溶液鉴别的是( )
| A、丁烷、1,3-丁二烯 |
| B、苯、己烯 |
| C、己烷、环己烯 |
| D、乙烯、丙炔 |
物质间常常相互联系、互相影响着,微粒也不例外.下列各组离子可能大量共存的是( )
| A、不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、C1O-、I- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、C1-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- |
| D、无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
有关化学用语表达正确的是( )
A、聚苯乙烯的结构简式: | ||||
B、S2-的结构示意图: | ||||
C、
| ||||
D、过氧化氢电子式: |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,胶体粒子的数目小于NA |
| D、1.8 g重水(D2O)中含NA个质子和NA个中子 |
以下说法不正确的是( )
| A、绿色食品是指不含任何化学物质的食品 |
| B、硅是制造太阳能电池的常用材料 |
| C、SiO2、SO2均属酸性氧化物 |
| D、光导纤维是以二氧化硅为主要原料制成的 |
如图所示的装置或操作正确的是( )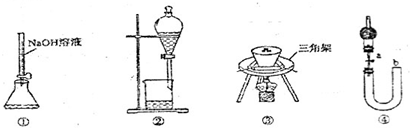

| A、用装置①量取15.00mL的NaOH溶液 |
| B、用装置②分离苯和水的混合物,苯应从下口流出 |
| C、用装置③陶瓷坩埚高温煅烧CaCO3固体 |
| D、关闭活塞a,从b处加水,以检查装置④的气密性 |
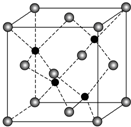 X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题:
X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题: