题目内容
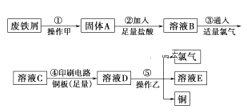
【题目】(7分)有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;
⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;
属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: 。
【答案】(7分)
(1)①②④⑦ ③⑤ ⑥⑨⑩ ⑧
(2)NaHCO3Na++HCO![]() (HCO
(HCO![]()
![]() H++CO
H++CO![]() )
)
(3)HCO![]() +CH3COOHCH3COO-+CO2↑+H2O
+CH3COOHCH3COO-+CO2↑+H2O
(4)Ba2++OH-+HCO![]() BaCO3↓+H2O
BaCO3↓+H2O
【解析】考查电解质概念及离子方程式的书写
(1)金属或有自由移动的离子才可导电,故①②④⑦可导电
强酸、强碱及大部分的盐为强电解质:⑥⑨⑩
弱酸、弱碱及水为弱电解质:⑧
而非电解质包括:③⑤
(2)碳酸氢钠为强电解质,全部电离:NaHCO3Na++HCO![]()
(3)醋酸为弱酸,不能拆为离子:HCO![]() +CH3COOHCH3COO-+CO2↑+H2O
+CH3COOHCH3COO-+CO2↑+H2O
(4)设NaHCO3的物质的量为1mol,则需要消耗1mol 的OH—:HCO![]() +OH—=CO
+OH—=CO![]() +H2O,生成的CO
+H2O,生成的CO![]() 又需要消耗1molBa2+生成沉淀:Ba2++OH-+HCO
又需要消耗1molBa2+生成沉淀:Ba2++OH-+HCO![]() BaCO3↓+H2O
BaCO3↓+H2O

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目