题目内容
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
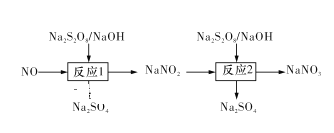
(1)在室温下,纯净的氮化镁(Mg3N2)为黄绿色的粉末,能与水反应,常用作触媒,实验室用如图1所示装置和药品制备少量氮化镁。
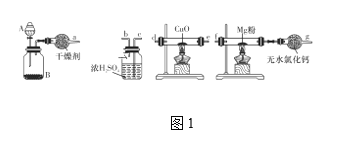
①A中盛装的是____,B中可盛装碱石灰,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接____、____接____、_b__接____。
③气体通过CuO这一装置的目的是什么?用化学方程式回答:______。
④无水氯化钙装置可防止外界空气中的水进入,以防_____________(化学方程式表示)的发生。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。
Ⅰ.合成碳酸镁晶体的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到产品碳酸镁晶体(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____。
②步骤3中加氨水后发生反应的离子方程式为________________
Ⅱ.测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶体,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶体反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。

③上述反应后期要升温到30 ℃,主要目的是_____________________
④若实验测得1.000 g碳酸镁晶体产生CO2的平均物质的量为a mol,则n为__________(用含a的表达式表示)。
⑤若称取100 g上述晶体进行热重分析,得到的热重曲线如图3所示,则合成的晶体中n=____(取整数)。
【答案】浓氨水 d e c b f 2NH3+3CuO![]() N2+3H2O+3Cu Mg3N2+6H2O===3Mg(OH)2+2NH3↑ 500mL容量瓶 Mg2++HCO3-+NH3·H2O+(n-1)H2O
N2+3H2O+3Cu Mg3N2+6H2O===3Mg(OH)2+2NH3↑ 500mL容量瓶 Mg2++HCO3-+NH3·H2O+(n-1)H2O![]() MgCO3·nH2O↓+NH4+。 升高温度,气体的溶解度减小,使溶解在水中的CO2逸出,便于吸收完全 1-84a/18a 1
MgCO3·nH2O↓+NH4+。 升高温度,气体的溶解度减小,使溶解在水中的CO2逸出,便于吸收完全 1-84a/18a 1
【解析】
根据题意可知,本题考查了物质含量的实验探究过程分析、实验装置的连接,运用各物质的化学性质和装置连接步骤分析。
(1)①A、B二者混合可制取氨气,而浓氨水和生石灰或氢氧化钠固体混合放热,可使一水合氨分解生成氨气。因此A中盛装的是浓氨水;
故答案为:浓氨水;
②根据实验目的及题给装置可知,按照气流的方向从左向右连接装置的顺序为:a接d,e接c,b接f;
故答案为:d; e ; c ;b ;f;
③气体通过CuO这一装置的目的是氨气有还原性,能还原氧化铜,生成氮气,则气体通过CuO这一装置的目的用化学方程式表示为:2NH3+3CuO![]() N2+3H2O+3Cu;
N2+3H2O+3Cu;
故答案为:2NH3+3CuO![]() N2+3H2O+3Cu;
N2+3H2O+3Cu;
④无水氯化钙装置可防止外界空气中的水进入,以防氮化镁和水发生反应生成氢氧化镁和氨气,化学方程式为:Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑;
3Mg(OH)2+2NH3↑;
故答案为:Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑;
3Mg(OH)2+2NH3↑;
(2)①配制0.5 mol·L-1MgSO4溶液500 mL,除提供的仪器外,还需要的仪器为500 mL容量瓶;
故答案为:500 mL容量瓶;
②步骤3中加氨水后反应生成碳酸镁结晶水合物,反应的离子方程式为Mg2++HCO3-+NH3·H2O+(n-1)H2O![]() MgCO3·nH2O↓+NH4+;
MgCO3·nH2O↓+NH4+;
故答案为:Mg2++HCO3-+NH3·H2O+(n-1)H2O![]() MgCO3·nH2O↓+NH4+;
MgCO3·nH2O↓+NH4+;
③题述反应后期将温度升到30 ℃,是为了使生成的二氧化碳全部逸出,便于其被氢氧化钠溶液完全吸收,从而减小测定产生的误差;
故答案为:升高温度,气体的溶解度减小,使溶解在水中的CO2逸出,便于吸收完全;
④若实验测得1.000 g碳酸镁晶须产生的CO2的平均物质的量为amol,依据碳元素守恒可知,晶须中碳酸镁的物质的量为amol,根据MgCO3·nH2O中碳酸镁和结晶水的物质的量之比为1∶n,得到![]() ,得到
,得到![]() ;
;
故答案为:![]() ;
;
⑤由题图3知400 ℃时剩余质量为82.3 g,这是该晶须失去结晶水后的质量,则有![]() ,解得n=1;
,解得n=1;
故答案为:1。