题目内容
(2013?江苏二模)氧化铜矿石含有CuO和Cu2(OH)2CO3,还含有Fe2O3、FeO和SiO2等.铜、铁是畜禽所必需的微量元素.某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:
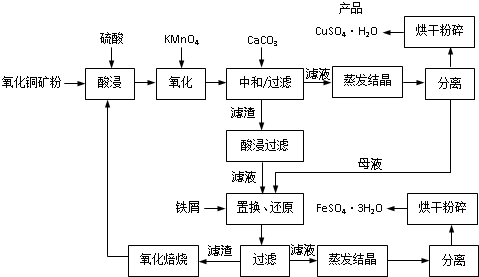
(1)氧化铜矿石粉碎的目的是
(2)写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式
(3)“中和/过滤”中加入CaCO3的目的是
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
(5)加入铁屑的作用是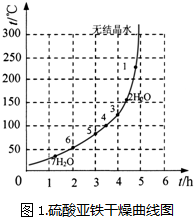
(6)表2和图1为“烘干粉碎”的试验结果.
表2.硫酸铜晶体(CuSO4?5H2O)干燥试验表
表2中,m为CuSO4?5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数.据此可确定由CuSO4?5H2O和FeSO4?7H2O脱水得流程中所示产品的适宜工艺条件分别为

(1)氧化铜矿石粉碎的目的是
增大接触面积,加快化学反应速率
增大接触面积,加快化学反应速率
.(2)写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
.(3)“中和/过滤”中加入CaCO3的目的是
适当降低溶液的酸性,使Fe3+水解成沉淀而除出
适当降低溶液的酸性,使Fe3+水解成沉淀而除出
.(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(5)加入铁屑的作用是
使母液中Fe3+转化为Fe2+、除去Cu2+
使母液中Fe3+转化为Fe2+、除去Cu2+
、提高硫酸亚铁晶体的纯度
提高硫酸亚铁晶体的纯度
.
(6)表2和图1为“烘干粉碎”的试验结果.
表2.硫酸铜晶体(CuSO4?5H2O)干燥试验表
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
160℃、3h
160℃、3h
,125(±5)℃、4.0h
125(±5)℃、4.0h
(分别指出两条件的温度和时间).分析:(1)反应物的接触面积与反应速率成正比;
(2)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳;
(3)碳酸钙和酸反应而使溶液酸性降低,利于铁生成氢氧化铁沉淀;
(4)根据各仪器的作用选取仪器;
(5)铁能和铜离子、铁离子反应;
(6)根据表2、图1产物与温度、时间的关系分析.
(2)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳;
(3)碳酸钙和酸反应而使溶液酸性降低,利于铁生成氢氧化铁沉淀;
(4)根据各仪器的作用选取仪器;
(5)铁能和铜离子、铁离子反应;
(6)根据表2、图1产物与温度、时间的关系分析.
解答:解:(1)反应物的接触面积与反应速率成正比,将氧化铜矿石粉碎,增大了反应物的接触面积,加快了反应速率,
故答案为:增大接触面积,加快化学反应速率;
(2)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,离子方程式为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,故答案为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(3)碳酸钙和酸反应生成盐和水,降低了溶液的酸性,从而时铁离子水解生成沉淀而除去,
故答案为:适当降低溶液的酸性,使Fe3+水解成沉淀而除出;
(4)实验室中过滤操作需要使用的玻璃仪器有盛放溶液的烧杯,起引流作用的玻璃棒,过滤作用的漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(5)母液中含有铁离子和铜离子,铁能和铁离子、铜离子发生氧化还原反应生成亚铁离子和铜单质,从而提高硫酸亚铁晶体的纯度,故答案为:使母液中Fe3+转化为Fe2+、除去Cu2+,提高硫酸亚铁晶体的纯度;
(6)由CuSO4?5H2O脱水得CuSO4?H2O结合表2知,要想得到目标产物,适宜的温度和时间分别是160℃、3h,
由FeSO4?7H2O脱水得FeSO4?3H2O结合图1知,要想得到目标产物,温度和时间分别是125(±5)℃、4.0h,
故答案为:160℃、3h,125(±5)℃、4.0h.
故答案为:增大接触面积,加快化学反应速率;
(2)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,离子方程式为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,故答案为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(3)碳酸钙和酸反应生成盐和水,降低了溶液的酸性,从而时铁离子水解生成沉淀而除去,
故答案为:适当降低溶液的酸性,使Fe3+水解成沉淀而除出;
(4)实验室中过滤操作需要使用的玻璃仪器有盛放溶液的烧杯,起引流作用的玻璃棒,过滤作用的漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(5)母液中含有铁离子和铜离子,铁能和铁离子、铜离子发生氧化还原反应生成亚铁离子和铜单质,从而提高硫酸亚铁晶体的纯度,故答案为:使母液中Fe3+转化为Fe2+、除去Cu2+,提高硫酸亚铁晶体的纯度;
(6)由CuSO4?5H2O脱水得CuSO4?H2O结合表2知,要想得到目标产物,适宜的温度和时间分别是160℃、3h,
由FeSO4?7H2O脱水得FeSO4?3H2O结合图1知,要想得到目标产物,温度和时间分别是125(±5)℃、4.0h,
故答案为:160℃、3h,125(±5)℃、4.0h.
点评:本题考查了制备实验方案设计,涉及知识点较多,明确物质的性质是解本题关键,难点是(6)中温度和时间的选取,明确图表的含义即可得出正确结论,同时考查学生分析问题和解决问题的能力,难度中等.

练习册系列答案
相关题目
