题目内容
已知:
(1)R-X
RCN
RCOOH
(2)
(3)
现用如下方法合成高效、低毒农药杀灭菊酯( ):
):

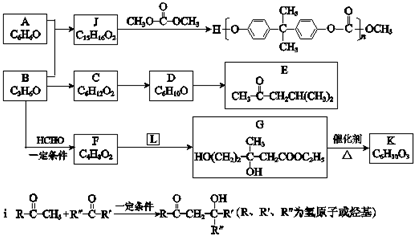
(1)F中所含官能团的名称是 ;合成G的反应类型是 .
(2)有关A的下列说法不正确的是 (填序号).
a.A与苯互为同系物 b.A的核磁共振氢谱有4组峰,且峰面积之比为3:1:1:1
c.充分燃烧等物质的量A和环己烷消耗氧气的量相等
d.A最多有13个原子处在同一平面上 e.A不能使酸性KMnO4溶液褪色
(3)写出I的结构简式: .
(4)写出C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式:
(5)H与银氨溶液水浴加热的离子方程式为: .
(6)D在硫酸存在下发生水解生成J:D
J写出符合下列要求的J的所有同分异构体的结构简式: .①苯环上有两个位于间位的取代基;②能水解成两种有机物;③可以发生银镜反应.
(1)R-X
| NaCl |
| H2O |
| H2SO4 |
(2)

(3)

现用如下方法合成高效、低毒农药杀灭菊酯(
 ):
):
(1)F中所含官能团的名称是
(2)有关A的下列说法不正确的是
a.A与苯互为同系物 b.A的核磁共振氢谱有4组峰,且峰面积之比为3:1:1:1
c.充分燃烧等物质的量A和环己烷消耗氧气的量相等
d.A最多有13个原子处在同一平面上 e.A不能使酸性KMnO4溶液褪色
(3)写出I的结构简式:
(4)写出C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式:
(5)H与银氨溶液水浴加热的离子方程式为:
(6)D在硫酸存在下发生水解生成J:D
| H2O |
| H2SO4 |
考点:有机物的合成
专题:有机物的化学性质及推断
分析:F与I在浓硫酸、加热条件下发生酯化反应生成杀灭菊酯,H发生信息(2)反应生成I,由杀灭菊酯的结构可知,F为 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .
.
E发生信息(1)中第2步反应生成F,则E为 ,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,据此解答.
,据此解答.
 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .
.E发生信息(1)中第2步反应生成F,则E为
 ,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,据此解答.
,据此解答.解答:
解:F与I在浓硫酸、加热条件下发生酯化反应生成杀灭菊酯,H发生信息(2)反应生成I,由杀灭菊酯的结构可知,F为 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .
.
E发生信息(1)中第2步反应生成F,则E为 ,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,
,
(1)由上述分析可知,F为 ,含有官能团为:羧基、氯原子,合成G是间甲基苯酚中酚羟基氢原子被苯环取代,属于取代反应,
,含有官能团为:羧基、氯原子,合成G是间甲基苯酚中酚羟基氢原子被苯环取代,属于取代反应,
故答案为:羧基、氯原子;取代反应;
(2)A的结构简式为 ,
,
a.甲苯与苯均含有1个苯环,形成1个CH2原子团,二者核外互为同系物,故a正确;
b.A的核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1,故b错误;
c.1molA完全燃烧消耗氧气为(7+
)mol=9mol,1mol环己烷消耗氧气为(6+
)mol=9mol,等物质的量的A与环己烷消耗氧气的量相等,故c正确;
d.旋转碳碳单键,可以使甲基中一个H原子处于苯环平面,甲苯最多有13个原子处在同一平面上,故d正确;
e.A中含有甲基,能被酸性高锰酸钾氧化为苯甲酸,使酸性KMnO4溶液褪色,故e正确,
故选:b;
(3)由上述分析可知,I的结构简式为 ,故答案为:
,故答案为: ;
;
(4)C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式: +3NaOH→2NaCl+H2O+
+3NaOH→2NaCl+H2O+ ,
,
故答案为: +3NaOH→2NaCl+H2O+
+3NaOH→2NaCl+H2O+ ;
;
(5)H与银氨溶液水浴加热的离子方程式为: ,
,
故答案为: ;
;
(6)D为 ,在硫酸存在下发生水解生成J,则J为
,在硫酸存在下发生水解生成J,则J为 ,符合下列要求的J的所有同分异构体:①苯环上有两个位于间位的取代基;②能水解成两种有机物,含有酯基;③可以发生银镜反应,应为甲酸形成的酯基,侧链为为-Cl、-CH2OOCH,或-CH2Cl、OOCH,故结构简式为
,符合下列要求的J的所有同分异构体:①苯环上有两个位于间位的取代基;②能水解成两种有机物,含有酯基;③可以发生银镜反应,应为甲酸形成的酯基,侧链为为-Cl、-CH2OOCH,或-CH2Cl、OOCH,故结构简式为 、
、 ,故答案为:
,故答案为: 、
、 .
.
 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .
.E发生信息(1)中第2步反应生成F,则E为
 ,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CH(Cl)CH3在氢氧化钠条件下反应生成E,根据E的结构可知,D为 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,
,(1)由上述分析可知,F为
 ,含有官能团为:羧基、氯原子,合成G是间甲基苯酚中酚羟基氢原子被苯环取代,属于取代反应,
,含有官能团为:羧基、氯原子,合成G是间甲基苯酚中酚羟基氢原子被苯环取代,属于取代反应,故答案为:羧基、氯原子;取代反应;
(2)A的结构简式为
 ,
,a.甲苯与苯均含有1个苯环,形成1个CH2原子团,二者核外互为同系物,故a正确;
b.A的核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1,故b错误;
c.1molA完全燃烧消耗氧气为(7+
| 8 |
| 4 |
| 12 |
| 4 |
d.旋转碳碳单键,可以使甲基中一个H原子处于苯环平面,甲苯最多有13个原子处在同一平面上,故d正确;
e.A中含有甲基,能被酸性高锰酸钾氧化为苯甲酸,使酸性KMnO4溶液褪色,故e正确,
故选:b;
(3)由上述分析可知,I的结构简式为
 ,故答案为:
,故答案为: ;
;(4)C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式:
 +3NaOH→2NaCl+H2O+
+3NaOH→2NaCl+H2O+ ,
,故答案为:
 +3NaOH→2NaCl+H2O+
+3NaOH→2NaCl+H2O+ ;
;(5)H与银氨溶液水浴加热的离子方程式为:
 ,
,故答案为:
 ;
;(6)D为
 ,在硫酸存在下发生水解生成J,则J为
,在硫酸存在下发生水解生成J,则J为 ,符合下列要求的J的所有同分异构体:①苯环上有两个位于间位的取代基;②能水解成两种有机物,含有酯基;③可以发生银镜反应,应为甲酸形成的酯基,侧链为为-Cl、-CH2OOCH,或-CH2Cl、OOCH,故结构简式为
,符合下列要求的J的所有同分异构体:①苯环上有两个位于间位的取代基;②能水解成两种有机物,含有酯基;③可以发生银镜反应,应为甲酸形成的酯基,侧链为为-Cl、-CH2OOCH,或-CH2Cl、OOCH,故结构简式为 、
、 ,故答案为:
,故答案为: 、
、 .
.
点评:本题考查有机物的推断与合成,需要学生对给予的信息进行利用,能较好的考查考生自学能力,是热点题型,注意根据杀灭菊酯的结构采取正、逆推法相结合进行推断,注意掌握官能团的性质与转化.

练习册系列答案
相关题目
下列反应的离子方程式中,书写正确的是( )
| A、实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-=CO2↑+H2O |
| B、将铝粉投入氢氧化钠溶液中:2Al+2OH-=2AlO2-+H2↑ |
| C、向Ca(ClO)2溶液中通过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2CH3COOH=H2SiO3↓+2CH3COO- |


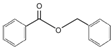 )可用于治疗疥螨,抗寄生虫,也可作麝香定香剂及樟脑代用品等.合成苯甲酸苄酯的方法有多种,下列路线是其中的两种合成方法:
)可用于治疗疥螨,抗寄生虫,也可作麝香定香剂及樟脑代用品等.合成苯甲酸苄酯的方法有多种,下列路线是其中的两种合成方法:
 的路线如下:
的路线如下:





