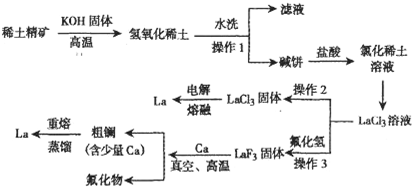
题目内容
由CO2、H2组成的混合气在同温、同压下与氮气的密度相同.则该混合气体中CO2、H2气体的体积比为( )
| A、29:8 | B、22:1 |
| C、13:8 | D、8:13 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据二氧化碳、氢气组成的混合气体在同温、同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,根据十字交叉法来解答该题.
解答:
解:二氧化碳、氢气组成的混合气体在同温、同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,由交叉法:

由十字交叉法可求得CO2和H2的体积比为13:8.
故选C.

由十字交叉法可求得CO2和H2的体积比为13:8.
故选C.
点评:本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,根据相同条件下气体的密度之比等于相对分子质量之比计算即可,注意十字交叉法的运用,难度不大.

练习册系列答案
相关题目
下列可以直接加热的仪器的是( )
| A、量筒 | B、烧杯 | C、试管 | D、漏斗 |
在同温同压下,两种物质的量相同的气体之间的关系是( )
| A、体积都为22.4L |
| B、具有相同的原子数 |
| C、具有相同的摩尔质量 |
| D、具有相同的气体摩尔体积 |
用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A、18gH2O含有的氢原子数目为NA |
| B、标准状况下,22.4LH2O含有的分子数目为NA |
| C、24g Mg变为Mg2+时失去的电子数为NA |
| D、常温常压下,71gCl2中含有的分子数为NA |
下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A、0.5 mol H2O含有的原子数目为1.5 NA |
| B、32 g O2所含的原子数目为NA |
| C、1 mol H2O含有的H2O分子数目为NA |
| D、0.5 NA个氯气分子的物质的量是0.5 mol |
下列各组中两种微粒所含电子数不相等的是( )
| A、H3O+和OH- |
| B、CH3+和NH4+ |
| C、CO和N2 |
| D、HNO2和NO2- |