题目内容
10分)利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):____________________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
20.(10分)(1) H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===  Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)C (3)D (4)①3.4 ②-56.8 kJ·mol-1
解析试题分析:(1)根据中和热数值为57.3 kJ·mol-1,稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===  Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)为了减少热量的散失,倒入氢氧化钠溶液时,必须一次迅速的倒入,选C;
(3)温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失,使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动,选D。
(4)①第1次实验盐酸和NaOH溶液起始平均温度为26.1,反应后温度为:29.5℃,反应前后温度差为:3.4℃;第2次实验盐酸和NaOH溶液起始平均温度为27.2℃,反应后温度为:32.3℃,反应前后温度差为:5.1℃;第3次实验盐酸和NaOH溶液起始平均温度为25.9℃,反应后温度为:29.2℃,反应前后温度差为:3.3℃;第4次实验盐酸和NaOH溶液起始平均温度为26.3,反应后温度为:29.8℃,反应前后温度差为:3.5℃;第2次实验温度比其它三次的实验温度,变化较大,舍弃这组数据,用实验1、3、4的温差求这三次的平均值为3.4;②50mL的0.25mol/L硫酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g?℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g?℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量为:1.4212kJ,所以生成1mol的水放出热量为1.4212kJ×(1/0.025=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol。
考点:考查中和热的测定。

下列有关物质的性质、制取或应用等的说法中正确的是( )
| A.用8%的盐酸蒸发浓缩获得30%的盐酸 |
| B.光纤和餐桌上的瓷盘都是硅酸盐制品 |
| C.可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
| D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
下列互为同位素的是
| A.613C和C60 | B.白磷和红磷 | C.乙醇和甲醚 | D.11H和12H |
下列有关物质结构的表述正确的是( )
A.次氯酸的电子式 | B.乙烯的分子式  |
C.钠离子的结构示意图 | D.碳-12原子 126C |
NH3.H2O.CH4三分子中键角大小顺序正确的是
| A.NH3>H2O>CH4 | B.CH4>NH3>H2O |
| C.CH4>H2O>NH3 | D.H2O>CH4>NH3 |
(14分)某实验小组用0.50mol/L氢氧化钠溶液和0.50mol/L硫酸溶液进行反应热的测定。
Ⅰ.配制0.50mol/L氢氧化钠溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体_________克。
(2)配制过程中,所需要的玻璃仪器有_____________________________________
Ⅱ.测定稀硫酸和稀氢氧化钠溶液反应的反应热实验装置如下: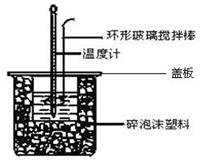
(3)如图装置中仪器环形玻璃搅拌棒作用是___________________________________;
(4)烧杯间填满碎泡沫塑料、大烧杯上加盖硬纸板的作用是__________________
(5)已知稀硫酸与稀氢氧化钠溶液发生中和反应生成1 mol水时,放出57.3 KJ热量。请写出硫酸与氢氧化钠发生中和反应的热化学方程式:__________________________________________,用0.2 mol 稀硫酸溶液与足量稀氢氧化钠溶液反应,能放出________kJ热量。
(6)在测定中和反应的反应热的实验中,下列叙述正确的是
| A.测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度 |
| B.中和反应的试验中,应快速将NaOH溶液一次倒入盛盐酸的小烧杯中 |
| C.可以用氢氧化钾代替氢氧化钠,浓硫酸代替稀硫酸 |
| D.在测定中和反应的反应热实验中,每完成一次反应热热测定,至少需要读三次温度 |
在2升的密闭容器中,发生以下反应:2A(g)+B(g)  2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
| A.1.6 mol | B.2.8 mol | C.2.4 mol | D.1.2 mol |
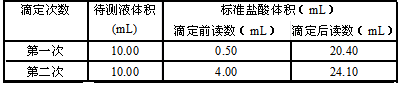
准确量取25.00mLKMnO4溶液,可选用的仪器是:
| A.50mL量筒 | B.10mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |