题目内容
4.在200mL 2mol•L-1MgCl2溶液中,溶质的物质的量为0.4mol.此溶液中Mg2+的物质的量浓度为2mol/L,Cl-的物质的量浓度为4mol/L.分析 根据n=cV计算溶质物质的量,Mg2+的物质的量浓度等于MgCl2的物质的量浓度,Cl-的物质的量浓度为MgCl2浓度的2倍.
解答 解:n(MgCl2)=0.2L×2mol/L=0.4mol,
c(Mg2+)=c(MgCl2)=2mol/L,
c(Cl-)=2c(MgCl2)=2×2mol/L=4mol/L,
故答案为:0.4mol;2mol/L;4mol/L.
点评 本题考查物质的量浓度有关计算,比较基础,注意理解电解质浓度与电解质离子浓度关系.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
15.下列叙述中,错误的是( )
| A. | 乙烷与氯气在光照下反应只生成一氯乙烷 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 |
9.C6H12O2属于酯类的同分异构体共有( )种.
| A. | 20 | B. | 21 | C. | 22 | D. | 24 |
16.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.
某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数.反应的化学方程式:2NH3(g)+CO2(g)$?_{分解}^{制备}$NH2COONH4(s).请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图.
(2)制备氨基甲酸铵的装置如下图2所示.生成的氨基甲酸铵小晶体悬浮在四氯化碳中.
①从反应后的混合物中分离出产品的实验方法是过滤(填操作名称).
②图3中浓硫酸的作用是吸收未反应的氨气,防止空气中的水蒸气进入反应器使氨基甲酸铵水解.
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡.实验测得不同温度下的平衡数据列于下表:
①下列选项可以判断该分解反应达到平衡的是AC.
A.密闭容器内混合气体的压强不变
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变△H>0(填“>”、“=”或“<”),25.0℃时分解平衡常数的值=1.6384×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”,“减少”或“不变”).

某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数.反应的化学方程式:2NH3(g)+CO2(g)$?_{分解}^{制备}$NH2COONH4(s).请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图.
(2)制备氨基甲酸铵的装置如下图2所示.生成的氨基甲酸铵小晶体悬浮在四氯化碳中.
①从反应后的混合物中分离出产品的实验方法是过滤(填操作名称).
②图3中浓硫酸的作用是吸收未反应的氨气,防止空气中的水蒸气进入反应器使氨基甲酸铵水解.
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡.实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.密闭容器内混合气体的压强不变
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变△H>0(填“>”、“=”或“<”),25.0℃时分解平衡常数的值=1.6384×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”,“减少”或“不变”).

13.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下表所示:
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子.
试写出:
(1)a粒子的原子结构示意图 ,b粒子的电子排布式1s22s22p6.
,b粒子的电子排布式1s22s22p6.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为NaOH>Mg(OH)2(用化学式表示).
(3)若d极易溶于水,在水溶液中的反应方程式为NH3+H2O=NH3•H2O,d分子的空间构型为三角锥形,键角为107.5°;若d为正四面体分子,其电子式为 .
.
(4)c粒子是OH-,f粒子是H3O+(用化学式表示),由c、f生成g的离子方程式为OH-+H3O+=2H2O.
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)a粒子的原子结构示意图
 ,b粒子的电子排布式1s22s22p6.
,b粒子的电子排布式1s22s22p6.(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为NaOH>Mg(OH)2(用化学式表示).
(3)若d极易溶于水,在水溶液中的反应方程式为NH3+H2O=NH3•H2O,d分子的空间构型为三角锥形,键角为107.5°;若d为正四面体分子,其电子式为
 .
.(4)c粒子是OH-,f粒子是H3O+(用化学式表示),由c、f生成g的离子方程式为OH-+H3O+=2H2O.
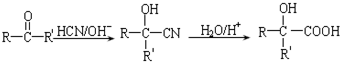
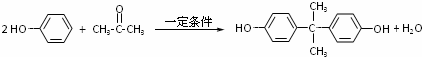 .
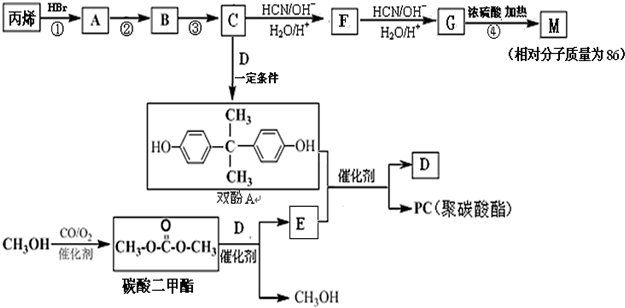
.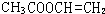 、
、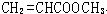 、
、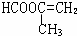 .
.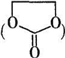 能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式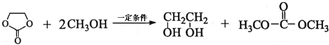
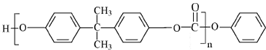 或
或 .
. 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应. (填“向左”、“向右”或“不”).
(填“向左”、“向右”或“不”).
 ;
;