题目内容
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。 利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
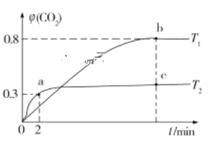
(1)温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=__________________。
(2)b点时CO的转化率为__________,化学反应的平衡常数K=_______(填表达式)。
(3)反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
(4)上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左”“向右”或“不”)移动。
(5)下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化
B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化
D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
【答案】0.15 mol·L 1·min 1 80% ![]() < 向右 BC
< 向右 BC
【解析】
(1)2 min时,CO2的体积分数为0.3,再根据v=![]() 计算速率;
计算速率;
(2)b点CO2的体积分数为0.8,利用三段法进行计算;
(3)根据先拐先平衡数据大可知,温度T2>T1,升高温度,CO2的体积分数减小,平衡逆向进行;
(4)根据浓度商与平衡常数之间的关系判断平衡是否发生和移动的方向;
(5)根据平衡移动的影响因素进行分析判断。
(1)2 min时,CO2的体积分数为0.3,根据三段法有
I2O5(s) + 5CO(g) ![]() 5CO2(g) + I2(s)
5CO2(g) + I2(s)

![]()
![]()
根据CO2的体积分数为0.3可知![]() ,解得x=0.6mol,因此v=
,解得x=0.6mol,因此v=![]() =
= =0.15mol/(Lmin);
=0.15mol/(Lmin);
(2)温度为T1时,CO2的体积分数为0.8,根据三段法有
I2O5(s) + 5CO(g) ![]() 5CO2(g) + I2(s)
5CO2(g) + I2(s)

![]()
![]()
根据CO2的体积分数为0.8可知![]() ,解得y=1.6mol,CO2的转化率为
,解得y=1.6mol,CO2的转化率为![]() ×100%=80%;
×100%=80%;
平衡常数K= ;
;
(3)由分析知升高温度平衡逆向进行,而升高温度平衡向着吸热的方向移动,因此该反应正向为放热反应,即ΔH<0;
(4)T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则:
I2O5(s) + 5CO(g) ![]() 5CO2(g) + I2(s)
5CO2(g) + I2(s)
平衡量(mol) 0.4 1.6
0.4+2 1.6+2
因此浓度商Qc=![]() =7.59 K=
=7.59 K=![]() =1024
=1024
Qc<K,因此平衡正向移动,即向右移动;
(5)A.该反应为等体积反应,压强不变不能证明达到平衡状态,A项错误;
B. 该反应气体质量及物质的量均发生变化,混合气体的平均相对分子质量不再变化,证明反应达到了平衡状态,B项正确;
C. 气体的质量发生变化,体积不变,当混合气的密度不再变化时,说明反应达到了平衡状态,C项正确;
D. 单位时间内消耗CO和生成CO2的物质的量之比为1∶1,不能证明正反应速率等于逆反应速率,不能证明反应达到平衡状态,D项错误;
答案选BC。
Q<K | 反应向正反应方向进行,v正>v逆 |
Q=K | 反应处于化学平衡状态,v正=v逆 |
Q>K | 反应向逆反应方向进行,v正<v逆 |

【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)