题目内容
A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A、E可形成AE3型分子,分子中只存在极性键.
(1)B元素在元素周期表中的位置是______.
(2)C的离子结构示意图为______,用电子式表示AE3的形成过程:______.
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有______.
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)______.
(1)B元素在元素周期表中的位置是______.
(2)C的离子结构示意图为______,用电子式表示AE3的形成过程:______.
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有______.
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)______.

设A的质子数为x,则B的质子数为x+9,C的质子数为x+2,则有x+x+2=x+9,x=7,则A为N元素,B为S元素,C为F元素,D与A同周期,其最高正价与最低负价代数和为零,则D为C元素,A、E可形成AE3型分子,分子中只存在极性键,应为NH3,则E为H元素,
(1)B为S元素,原子序数为16,原子核外有3个电子层,最外层电子数为6,则应位于第三周期VIA族,故答案为:第三周期VIA族;
(2)C为F元素,原子核内有9个质子,对应的离子核外有8个电子,2个电子层,则离子的结构示意图为
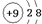
,NH3为共价化合物,用电子式表示的形成过程为
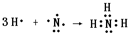
,故答案为:
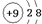
;
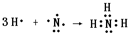
;
(3)由元素A、C及氢元素形成的化合物为NH4F,为离子化合物,含有离子键和极性共价键,故答案为:离子键、极性共价键;
(4)A为N元素,D为C元素,N的非金属性较C强,所对应的最高价氧化物的水化物的酸性也强,将硝酸加入到碳酸钠溶液中可发生反应:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑,可用以证明C与N的非金属性强弱,
故答案为:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑(或其他合理方法).
(1)B为S元素,原子序数为16,原子核外有3个电子层,最外层电子数为6,则应位于第三周期VIA族,故答案为:第三周期VIA族;
(2)C为F元素,原子核内有9个质子,对应的离子核外有8个电子,2个电子层,则离子的结构示意图为
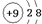
,NH3为共价化合物,用电子式表示的形成过程为
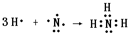
,故答案为:
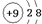
;
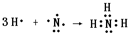
;
(3)由元素A、C及氢元素形成的化合物为NH4F,为离子化合物,含有离子键和极性共价键,故答案为:离子键、极性共价键;
(4)A为N元素,D为C元素,N的非金属性较C强,所对应的最高价氧化物的水化物的酸性也强,将硝酸加入到碳酸钠溶液中可发生反应:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑,可用以证明C与N的非金属性强弱,
故答案为:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑(或其他合理方法).

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:

