题目内容
下列叙述正确的是
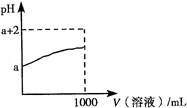
- A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2] = 1∶1时,HCO3-完全转化为CaCO3
- B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2] = 1∶1时,能得到澄清溶液
- C.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+) = 1∶1时,铝元素以AlO2-形式存在
- D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3) = 1∶1时,溶液中铁元素只以Fe3+形式存
A
A项,HCO3-与OH-以1∶1恰好完全反应,离子方程式为:HCO3-+ OH-= CO32-+H2O,题给条件中,OH-过量,HCO3-完全转化为CO32-,A项正确。B项,CO2与澄清石灰水的反应方程式有①少量CO2:CO2+Ca(OH)2=CaCO3↓+H2O ②CO2足量:CO2+Ca(OH)2= Ca(HCO3)2,所以B中将会得到白色沉淀,B不正确。AlCl3溶液与烧碱溶液反应,当NaOH溶液少量时,离子方程式:Al3+ +3OH-=Al(OH)3↓ ;当NaOH溶液过量时,离子方程式为:Al(OH)3+ OH- =AlO2-+2H20,由此判断,当n(OH-)∶n(Al3+) = 1∶1时,只能出现白色沉淀,C不正确。Fe与稀硝酸反应的方程式:①Fe过量时:3Fe + 8H+ + 2NO3- = 3Fe2+ + 2NO↑+ 4H2O ②硝酸过量时:Fe + 4H+ + NO3- = Fe3+ + NO↑+ 2H2O,当n(Fe)∶n(HNO3) = 1∶1时,则Fe过量,所以D不正确。
A项,HCO3-与OH-以1∶1恰好完全反应,离子方程式为:HCO3-+ OH-= CO32-+H2O,题给条件中,OH-过量,HCO3-完全转化为CO32-,A项正确。B项,CO2与澄清石灰水的反应方程式有①少量CO2:CO2+Ca(OH)2=CaCO3↓+H2O ②CO2足量:CO2+Ca(OH)2= Ca(HCO3)2,所以B中将会得到白色沉淀,B不正确。AlCl3溶液与烧碱溶液反应,当NaOH溶液少量时,离子方程式:Al3+ +3OH-=Al(OH)3↓ ;当NaOH溶液过量时,离子方程式为:Al(OH)3+ OH- =AlO2-+2H20,由此判断,当n(OH-)∶n(Al3+) = 1∶1时,只能出现白色沉淀,C不正确。Fe与稀硝酸反应的方程式:①Fe过量时:3Fe + 8H+ + 2NO3- = 3Fe2+ + 2NO↑+ 4H2O ②硝酸过量时:Fe + 4H+ + NO3- = Fe3+ + NO↑+ 2H2O,当n(Fe)∶n(HNO3) = 1∶1时,则Fe过量,所以D不正确。

练习册系列答案
相关题目
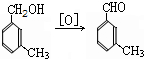
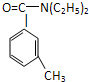 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH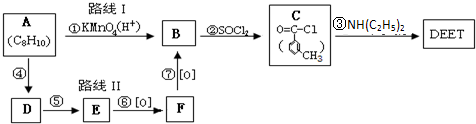
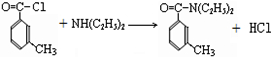
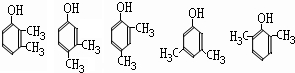 (任写2种)
(任写2种)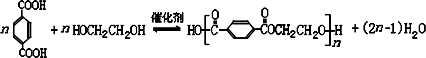
 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.