题目内容
一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸的稀溶液.(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是
②同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是
③当其c(H+)相同时,物质的量浓度由大到小的顺序为
④当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气(相同状况),则开始时反应速率的大小关系是
⑤将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为
①当其物质的量浓度相同时,c(H+)由大到小的顺序是
b>a>c
b>a>c
,②同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是
b>a=c
b>a=c
,③当其c(H+)相同时,物质的量浓度由大到小的顺序为
c>a>b
c>a>b
,④当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气(相同状况),则开始时反应速率的大小关系是
a=b=c
a=b=c
.⑤将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为
c>a=b
c>a=b
_.分析:①物质的量浓度相等的酸,硫酸和氯化氢是强电解质,完全电离,醋酸是一元弱酸,部分电离,据此确定氢离子浓度大小;
②同体积同物质的量浓度的三种酸,中和NaOH能力与氢的物质的量成之比,氢的物质的量越大,需要的氢氧化钠的物质的量越大;
③如果酸是强电解质,一元酸的浓度与氢离子浓度相等,二元酸的浓度为氢离子浓度的一半;如果酸是弱电解质,一元酸的浓度大于氢离子浓度;
④与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大;
⑤强酸溶液稀释10倍,氢离子浓度变为原来的
,弱酸溶液稀释10倍,氢离子浓度变为大于原来的
.
②同体积同物质的量浓度的三种酸,中和NaOH能力与氢的物质的量成之比,氢的物质的量越大,需要的氢氧化钠的物质的量越大;
③如果酸是强电解质,一元酸的浓度与氢离子浓度相等,二元酸的浓度为氢离子浓度的一半;如果酸是弱电解质,一元酸的浓度大于氢离子浓度;
④与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大;
⑤强酸溶液稀释10倍,氢离子浓度变为原来的
| 1 |
| 10 |
| 1 |
| 10 |
解答:解:①氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c,故答案为:b>a>c;
②同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c,故答案为b>a=c;
③氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,
物质的量浓度由大到小的顺序为c>a>b,故答案为:c>a>b;
④与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c,故答案为a=b=c;
⑤强酸溶液稀释10倍,氢离子浓度变为原来的
,弱酸溶液稀释10倍,氢离子浓度变为大于原来的
,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b,故答案为c>a=b.
②同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c,故答案为b>a=c;
③氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,
物质的量浓度由大到小的顺序为c>a>b,故答案为:c>a>b;
④与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c,故答案为a=b=c;
⑤强酸溶液稀释10倍,氢离子浓度变为原来的
| 1 |
| 10 |
| 1 |
| 10 |
点评:本题考查了弱电解质的电离及溶液中离子浓度大小的比较,根据电解质的强弱及酸的元数来分析解答即可,难度较大,注意弱电解质稀释时溶液中各种离子浓度的变化,为易错点.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目




 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。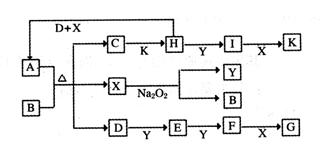
 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol
D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol
D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。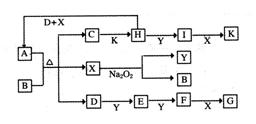
 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5
mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5
mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。