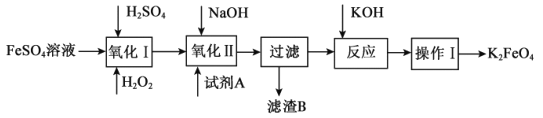
题目内容
【题目】溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
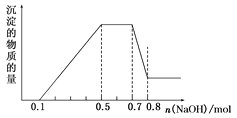
A.溶液中一定不含CO32-,可能含有SO42-和NO3-
B.在滴加NaOH溶液物质的量为0.5~0.7mol时,发生离子反应为Al3++4OH-=AlO2-+2H2O
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(NH4+)∶n(Mg2+)=2∶4∶1
【答案】D
【解析】
根据题意知,①溶液中加入铝片,产生无色无味的气体为氢气,则溶液中有大量氢离子,则没有碳酸根和硝酸根离子,根据电中性原则知,溶液中一定含有硫酸根;②加入NaOH溶液,产生白色沉淀,说明溶液中一定不含铁离子;当溶液中含氢离子、铵根离子、镁离子、铝离子时,加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根离子反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠。
A、溶液中加入铝片,产生无色无味的气体为氢气,则溶液中有大量氢离子,则一定不含CO32-和NO3-,根据电中性原则知,一定含有SO42-,故A错误;
B、根据题给图像知,在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:NH4++OH-=NH3·H2O,故B错误;
C、根据题给图像知,溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+,故C错误;
D、根据题给图像分析,氢离子消耗氢氧根离子的物质的量是0.1mol,所以氢离子的物质的量是0.1mol,氢氧化钠为0.5至0.7mol时,发生的离子反应为:NH4++OH-=NH3·H2O,所以铵离子的物质的量为0.2mol ,氢氧化钠为0.7至0.8mol时,发生反应Al(OH)3+OH-=AlO2-+2H2O,所以Al3+的物质的量是0.1mol,镁离子的物质的量是(0.4mol-0.1mol ×3)÷2=0.05mol,n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1,故D正确。