题目内容
【题目】锗是重要的半导体材料之一。碳、硅、锗位于同主族。
(1)基态锗原子的价层电子排布式为__________________。
(2)几种晶体的熔点和硬度如表所示。
晶体 | 金刚石 | 碳化硅 | 二氧化硅 | 硅 | 锗 |
熔点/℃ | 3 550 | 2 700 | 1 710 | 1 410 | 1 211 |
硬度 | 10 | 9.5 | 7 | 6.5 | 6.0 |
①碳化硅的晶体类型是__________________。
②二氧化硅的熔点很高,而干冰(固体二氧化碳)易升华,其主要原因是__________________。
③硅的熔点高于锗的,其主要原因是___________________________。
(3)![]() 的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
(4)1个CS2分子中含_________个π键。
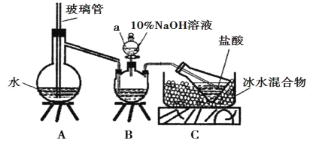
(5)锗的氧化物晶胞如图所示。已知:该氧化物的摩尔质量为M g·mol1,NA代表阿伏加德罗常数的值,晶胞密度为 ρ g·cm3。该晶胞的化学式为_________。氧原子的配位数为_________。该晶胞参数为_________cm(用代数式表示)。
 。
。
【答案】 4s24p2 原子晶体 二氧化硅是原子晶体,干冰是分子晶体 硅和锗都是原子晶体,硅的原子半径小于锗的,Si—Si键的键能大于Ge—Ge键的键能 平面三角形 sp3 2 GeO 4 ![]()
【解析】(1)锗的原子序数为32,价层电子排布式为4s24p2。
(2)①根据碳化硅的熔点和硬度知,碳化硅是原子晶体。②二氧化硅是原子晶体,而干冰是分子晶体,二氧化硅中存在较强的共价键,干冰中分子间作用力较弱。③硅和锗都是原子晶体,但是硅的原子半径小于锗的,故Si—Si键的键能大于Ge—Ge键的键能。
(3)![]() 中碳原子的价层有3对电子,孤电子对数为0,立体构型为平面三角形;GeCl4中锗的价层有4对电子,孤电子对数为0,锗的杂化类型为sp3。
中碳原子的价层有3对电子,孤电子对数为0,立体构型为平面三角形;GeCl4中锗的价层有4对电子,孤电子对数为0,锗的杂化类型为sp3。
(4)CS2的结构式为S=C=S,则1个CS2分子中含有2个π键。
(5)观察题给晶胞,8个Ge位于立方体顶点、6个Ge位于面心;4个O位于立方体内部。1个晶胞含4个Ge和4个O,化学式为GeO。观察图示知,1个O与4个Ge成键,氧原子的配位数为4。设晶胞参数为a cm,由ρ=![]()
![]() ,得:a=
,得:a=![]()
![]() 。
。

 提分百分百检测卷单元期末测试卷系列答案
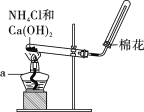
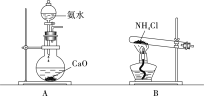
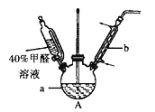
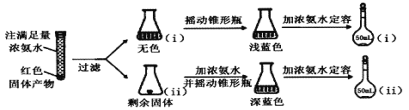
提分百分百检测卷单元期末测试卷系列答案【题目】下列实验装置不能达到实验目的的是
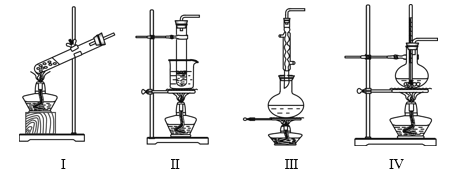
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D