题目内容
(15分)四种主族元素的性质或结构信息如下:
| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |
(2)Y单质溶于热浓的硫酸产生的气体的化学式为 。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式: 。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液 E.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源 (填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是 。

(1)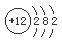 ; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-
; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-
4)B C E (5)正极 溶液逐渐变成浅绿色。
解析试题分析:根据题意可知:X是Al;Y是S;Z是Br;M是Mg。(1)Mg的原子结构示意图是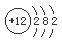 ;在上述元素中金属性最强的元素是Mg,其最高价氧化物对应的水化物碱性最强,化学式是Mg(OH)2;(2)(2)S单质溶于热浓的硫酸发生反应: S+2H2SO4(浓)△3SO2↑+2H2O产生的气体的化学式为SO2,(3)活动性强的能把活动性弱的从化合物中置换出来。能体现Z单质比Y单质活泼性强的一个化学方程式:Na2S+ Br2 =" S↓+" 2NaBr;离子方程式是S2- + Br2 =" S" ↓+ 2Br-。(4)A.Al+ 3CuSO4= 3Cu+Al2(SO4)3.错误。B.Fe2O3与Al发生反应要在高温条件下,在常温不能反应。正确。C.在常温下Al遇浓硫酸会发生钝化,使反应不能在进行。正确。D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑.错误。E.Na2CO3固体与Al不能发生反应。正确。因此选项为B C E。(5)用惰性电极电解FeBr3溶液。由于阴离子的放电能力Br->OH-,所以在与电源的正极相连接的阳极碳棒上发生反应:2Br--2e-=Br2. Br2容易溶解在煤油中,所以煤油颜色将变深,在阴极碳棒上发生反应:2Fe3++2e-=2Fe2+;附近的水溶液由黄色溶液逐渐变成浅绿色。
;在上述元素中金属性最强的元素是Mg,其最高价氧化物对应的水化物碱性最强,化学式是Mg(OH)2;(2)(2)S单质溶于热浓的硫酸发生反应: S+2H2SO4(浓)△3SO2↑+2H2O产生的气体的化学式为SO2,(3)活动性强的能把活动性弱的从化合物中置换出来。能体现Z单质比Y单质活泼性强的一个化学方程式:Na2S+ Br2 =" S↓+" 2NaBr;离子方程式是S2- + Br2 =" S" ↓+ 2Br-。(4)A.Al+ 3CuSO4= 3Cu+Al2(SO4)3.错误。B.Fe2O3与Al发生反应要在高温条件下,在常温不能反应。正确。C.在常温下Al遇浓硫酸会发生钝化,使反应不能在进行。正确。D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑.错误。E.Na2CO3固体与Al不能发生反应。正确。因此选项为B C E。(5)用惰性电极电解FeBr3溶液。由于阴离子的放电能力Br->OH-,所以在与电源的正极相连接的阳极碳棒上发生反应:2Br--2e-=Br2. Br2容易溶解在煤油中,所以煤油颜色将变深,在阴极碳棒上发生反应:2Fe3++2e-=2Fe2+;附近的水溶液由黄色溶液逐渐变成浅绿色。
考点:考查元素的推断、性质、原子结构示意图、离子方程式的书写及电解原理的应用的知识。

(12分)【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
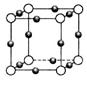
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为
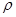 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。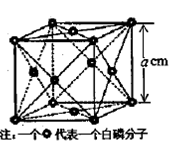
(14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含 、NA的计算式表示)
、NA的计算式表示)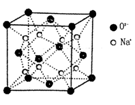
(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式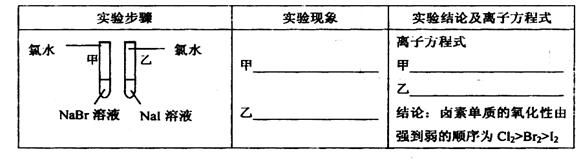
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
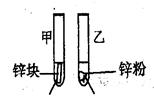 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074 nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
(1)写出C元素在周期表中的位置 ,写出D元素最高价氧化物的水化物电子式 ;
(2)写出B单质与水反应的离子方程式 ;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式 ;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为 ;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为 NA。
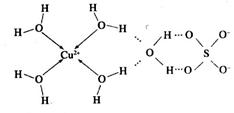
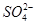 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。 配离子。已知
配离子。已知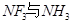 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。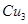 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。