题目内容
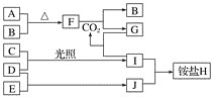
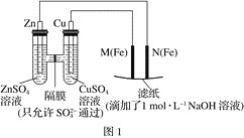
【题目】某课外小组分别用如图所示装置对原电池和电解池原理进行实验探究。
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是____(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为___。
(3)实验过程中,SO42-___(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有___。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
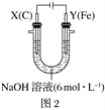
(4)电解过程中,X极区溶液的pH___(填“增大”、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O、___。
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少___g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为___。
【答案】A 2H++2e-=H2↑ 从右向左 滤纸上M极附近有红褐色斑点产生 增大 4OH--4e-=2H2O+O2↑ 0.28 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】
图1装置左侧是原电池,发生的电极反应式,锌电极:![]() ,铜电极:
,铜电极:![]() ;右侧为电解池,电解液为
;右侧为电解池,电解液为![]() 溶液,
溶液, ![]() 电极为阳极,电极反应式为:
电极为阳极,电极反应式为:![]() ,
,![]() 电极为阴极,电极反应式为:
电极为阴极,电极反应式为:![]() ;图2装置
;图2装置![]() 电极为阳极,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O、4OH--4e-=2H2O+O2↑,
电极为阳极,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O、4OH--4e-=2H2O+O2↑,![]() 电极为阴极,电极反应式为:
电极为阴极,电极反应式为:![]() 。
。
I.(1)电极反应不变的情况下,只有在金属活动顺序表中活泼性低于铜才可以替代Cu作电极,只有铝的活泼性大于铜,因此选铝;
(2)![]() 电极为阴极,考虑阳离子的放电顺序,该环境中阳离子为
电极为阴极,考虑阳离子的放电顺序,该环境中阳离子为![]() ,根据放电顺序,
,根据放电顺序,![]() 发生反应,电极反应式为:
发生反应,电极反应式为:![]() ;
;
(3)![]() 在溶液中从正极移向负极,所以从右向左移动;
在溶液中从正极移向负极,所以从右向左移动;![]() 电极为阳极,电极反应式为:
电极为阳极,电极反应式为:![]() ,
,![]() ,被氧化成
,被氧化成![]() ,所以可以看到,在
,所以可以看到,在![]() 电极附近有红褐色斑点产生;
电极附近有红褐色斑点产生;
故答案为:A;2H++2e-=H2↑;从右向左;滤纸上M极附近有红褐色斑点产生;
II.(4) 图![]() ,消耗氢离子,所以X极区溶液的pH增大;
,消耗氢离子,所以X极区溶液的pH增大;
(5)Y极为阳极,碱性环境溶液不浑浊,则Fe-6e-+8OH-=FeO42-+4H2O,且(6)中涉及到Y极有气体产生,所以溶液中的阴离子OH-也会放电,发生电极反应:4OH--4e-=2H2O+O2↑;
(6)X极的气体![]() ,Y极气体
,Y极气体![]() ,X极得到电子
,X极得到电子![]() ,Y极生成气体失去
,Y极生成气体失去![]() ,则铁失去电子
,则铁失去电子![]() ,则铁的质量减少
,则铁的质量减少![]() ;
;
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,根据氧化还原反应特点,该电池正极发生还原反应:2FeO42-+6e-+5H2O=Fe2O3+10OH-;
故答案为:增大;4OH--4e-=2H2O+O2↑;0.28;2FeO42-+6e-+5H2O=Fe2O3+10OH-。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案