题目内容
5.下列说法正确的是( )| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
分析 A、NH4Cl 浓度越小,NH4+水解程度越大;
B、当溶液中c(NH4+)=c(C1-),说明溶液呈中性,有c(H+)=c(OH-)=10-7,NH3•H2O的电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;
C、要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,应是平衡向电离的方向移动,结合影响平衡移动的因素解答该题;
D、等体积等PH值的酸,酸的浓度越大,酸性越弱.
解答 解:A、NH4Cl 浓度越小,NH4+水解程度越大,不考虑水解1L 0.50mol•L-1NH4Cl 溶液与2L 0.25mol•L-1 NH4Cl 溶液铵根的物质的量相同,但0.25mol•L-1NH4Cl 溶液中铵根水解程度大,所以含NH4+ 物质的量前者大,故A错误;
B、当溶液中c(NH4+)=c(C1-),说明溶液呈中性,有c(H+)=c(OH-)=10-7,故NH3•H2O的电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.005×1{0}^{-7}}{0.5(a-0.01)}$=$\frac{1{0}^{-9}}{a-0.01}$,故B正确;
C、加入少量烧碱溶液,反应生成CH3COO-,c(H+)减小,由于CH3COO-对CH3COOH的电离起到抑制作用,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值减小,故C错误;
D、当体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的物质的量大于HB的物质的量,溶液的体积相等,HA的物质的量浓度大于HB的,所以说明酸性:HA<HB,故D错误;
故选B.
点评 本题考查了盐类水解程度大小的影响因素、电离平衡常数的计算、弱酸的电离平衡移动、pH相等的酸,酸性越弱其浓度越大,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | sp1 | B. | sp2 | C. | sp2 | D. | sp3 |
| A. | Na2S和AlCl3 | B. | 乙烷与乙烯 | C. | 直馏汽油与苯 | D. | CO2与SO2 |
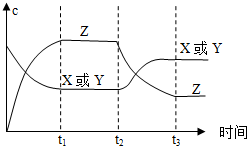 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )| A. | 升高温度 | B. | 减小Z的浓度 | C. | 增大压强 | D. | 增大X或Y的浓度 |
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
| A. | K+、Ba2+、NO3-、Cl- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Ca2+、K+、SO32-、NO3- | D. | Na+、K+、Cu2+、Br- |
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr. (1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.
(1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.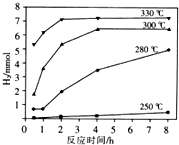 天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体.
天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体. .
.