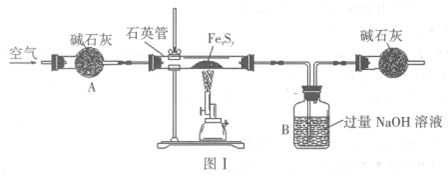
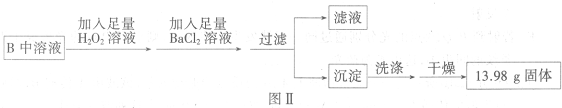
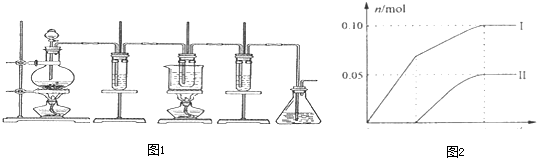
题目内容
有一白色粉末X,对X进行检验时,所做实验和现象是:
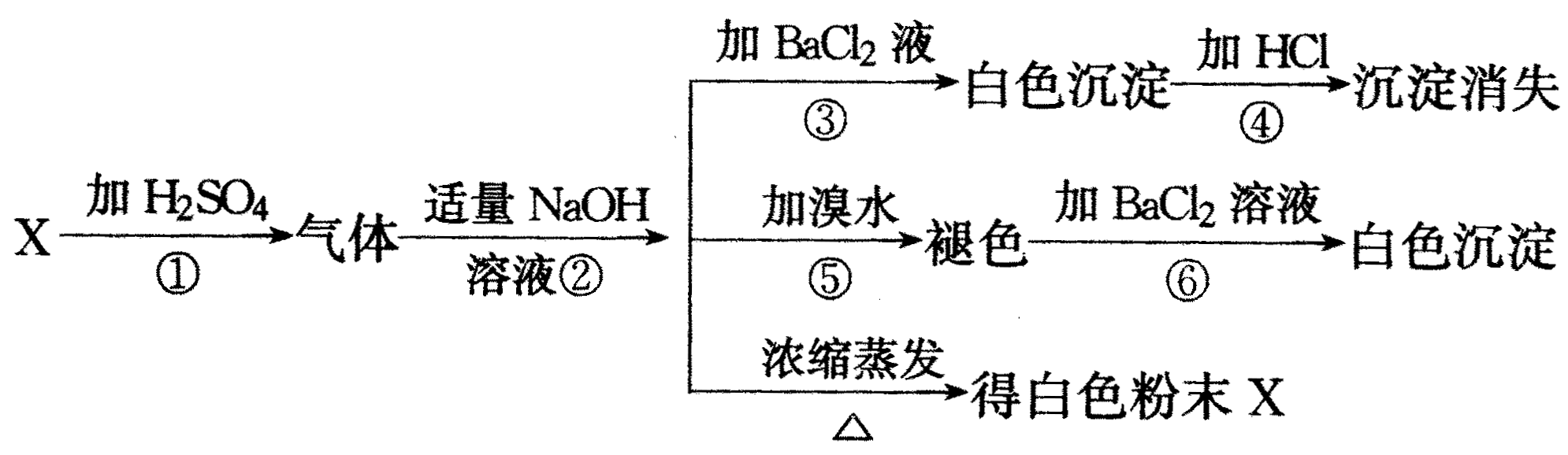
(1)写出X的化学式________;
(2)写出①步反应的化学方程式________;
(3)写出②步与③步的离子方程式________;________.
答案:
解析:
解析:
|
(1)Na2SO3 (2)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O (3)SO2+2OH-= |

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目