题目内容
从100mL某浓度的氢氧化钠溶液中取出50mL,加入5.4g铝粉,恰好完全反应.试计算:(1)生成氢气在标准状况下的体积.
(2)该氢氧化钠溶液的物质的量浓度.
【答案】分析:根据n=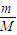 计算5.4g铝粉的物质的量,根据方程式计算NaOH、氢气的物质的量,
计算5.4g铝粉的物质的量,根据方程式计算NaOH、氢气的物质的量,
(1)根据V=nVm计算氢气的体积;
(2)根据c=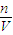 计算氢氧化钠溶液的物质的量浓度.
计算氢氧化钠溶液的物质的量浓度.
解答:解:5.4g铝粉的物质的量为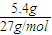 =0.2mol,则:
=0.2mol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 2 3
0.2mol n(NaOH) n(H2)
故n(NaOH)=0.2mol,
n(H2)=0.2mol× =0.3mol,
=0.3mol,
(1)氢气的体积为0.3mol×22.4L/mol=6.72L,
答:生成H2的标况下体积为6.72L;
(2)氢氧化钠溶液的物质的量浓度为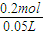 =4mol/L,
=4mol/L,
答:NaOH溶液的物质的量浓度为4mol/L.
点评:本题考查方程式的有关计算,难度不大,旨在考查学生对基础知识的理解掌握,注意氢氧化钠溶液的体积.
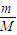 计算5.4g铝粉的物质的量,根据方程式计算NaOH、氢气的物质的量,
计算5.4g铝粉的物质的量,根据方程式计算NaOH、氢气的物质的量,(1)根据V=nVm计算氢气的体积;
(2)根据c=
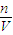 计算氢氧化钠溶液的物质的量浓度.
计算氢氧化钠溶液的物质的量浓度.解答:解:5.4g铝粉的物质的量为
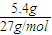 =0.2mol,则:
=0.2mol,则:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 2 3
0.2mol n(NaOH) n(H2)
故n(NaOH)=0.2mol,
n(H2)=0.2mol×
 =0.3mol,
=0.3mol,(1)氢气的体积为0.3mol×22.4L/mol=6.72L,
答:生成H2的标况下体积为6.72L;
(2)氢氧化钠溶液的物质的量浓度为
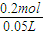 =4mol/L,
=4mol/L,答:NaOH溶液的物质的量浓度为4mol/L.
点评:本题考查方程式的有关计算,难度不大,旨在考查学生对基础知识的理解掌握,注意氢氧化钠溶液的体积.

练习册系列答案
相关题目
 (3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
(3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.