题目内容
【题目】硫元素形成的化合物有着广泛的用途。 请回答下列问题:
(1) 过二硫酸及其盐在工业上常用作强氧化剂。
①过二硫酸的结构为 ,其中氧元素的化合价为________。
,其中氧元素的化合价为________。
②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色。该反应的离子方程式为______。
③电解法是制备过二硫酸钾的方法之一, 其装置示意图如下:

则:b 为电源的______极; 阳极反应式为_________________; 导线中流过 1 mol 电子时, 理论上通过阳离子交换膜的K+的数目为___________。
(2)Na2SO4是重要的工业原料,检验其溶液中含有SO42-的操作及现象为______________。
【答案】 -2 价和-1 价 5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+ 负 2SO42--2e-=S2O82- NA或 6.02×1023 取待测液少量于洁净试管中,加入足量稀盐酸无明显现象, 再加 BaCl2溶液产生白色沉淀,则溶液中含有 SO42-
【解析】(1)①过二硫酸的结构为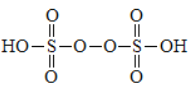 ,其中过氧键氧元素的化合价为-1价,其余氧元素的化合价是-2价。②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色,说明锰离子被氧化为高锰酸根离子,因此根据电子得失守恒和原子守恒可知该反应的离子方程式为5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+。③硫酸根在阳极失去电子转化为过二硫酸钾,阴极是溶液中的氢离子得到电子转化为氢气,即A是氢气,所以b 为电源的负极,阳极反应式为2SO42--2e-=S2O82-;导线中流过1 mol电子时,根据电荷守恒可知理论上通过阳离子交换膜的K+的数目为NA或 6.02×1023。(2)检验其溶液中含有SO42-的操作及现象为:取待测液少量于洁净试管中,加入足量稀盐酸无明显现象,再加 BaCl2溶液产生白色沉淀,则溶液中含有 SO42-。
,其中过氧键氧元素的化合价为-1价,其余氧元素的化合价是-2价。②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色,说明锰离子被氧化为高锰酸根离子,因此根据电子得失守恒和原子守恒可知该反应的离子方程式为5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+。③硫酸根在阳极失去电子转化为过二硫酸钾,阴极是溶液中的氢离子得到电子转化为氢气,即A是氢气,所以b 为电源的负极,阳极反应式为2SO42--2e-=S2O82-;导线中流过1 mol电子时,根据电荷守恒可知理论上通过阳离子交换膜的K+的数目为NA或 6.02×1023。(2)检验其溶液中含有SO42-的操作及现象为:取待测液少量于洁净试管中,加入足量稀盐酸无明显现象,再加 BaCl2溶液产生白色沉淀,则溶液中含有 SO42-。