题目内容
20.下列自然或生活中的事例不属于氧化还原反应的是( )| A. | 动物呼吸 | B. | 植物光合作用 | C. | 金属生锈 | D. | 石膏点制豆腐 |
分析 含元素化合物的变化,为氧化还原反应,以此来解答.
解答 解:A.动物有氧呼吸时,氧气参与下将有机物氧化分解,O元素的化合价变化,为氧化还原反应,故A不选;
B.植物光合作用利用光能将二氧化碳和水合成有机物,并产生氧气,O元素的化合价变化,为氧化还原反应,故B不选;
C.金属生锈,Fe失去电子被氧化,Fe、O元素的化合价变化,为氧化还原反应,故C不选;
D.石膏点制豆腐是胶体的凝聚过程,没有发生化学变化,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列仪器中,没有零刻度的是( )
| A. | 托盘天平 | B. | 滴定管 | C. | 温度计 | D. | 容量瓶 |
8.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)═4NO2(g)+O2(g),△H>0
①下表为该反应在T1温度下的部分实验数据
则500s内NO2的平均生成速率为5.92×10-3mol/(L•s).
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示.
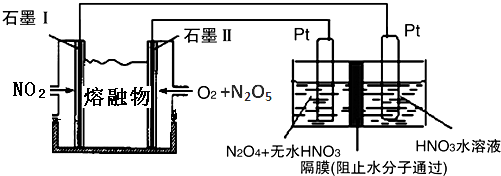
写出石墨I电极上发生反应的电极反应式NO2+NO3--e-═N2O5.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
2N2O5(g)═4NO2(g)+O2(g),△H>0
①下表为该反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示.

写出石墨I电极上发生反应的电极反应式NO2+NO3--e-═N2O5.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
15.砷为第四周期第VA族元素,根据其在元素周期表中的位置推测,砷不可能具有的性质是( )
| A. | 砷表现出一定的金属性 | B. | 砷在通常情况下是固体 | ||
| C. | 砷酸H3AsO4是一种氧化性强酸 | D. | 砷难与H2化合,砷化氢极不稳定 |
12.将4mol 甲烷与氯气发生取代反应,待反应完全后测知四种取代物物质的量相同,测消耗的氯气有( )
| A. | 2mol | B. | 10mol | C. | 7.5mol | D. | 6mol |
10.下列有关化学反应速率的说法不正确的是( )
| A. | 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间 | |
| B. | 化学反应达到最大限度时,正逆反应速率也达到最大且相等 | |
| C. | 用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 | |
| D. | 用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
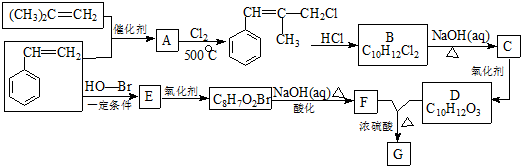
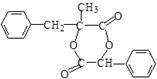 .
.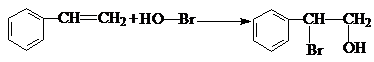 .
.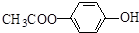 和
和 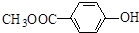 .
.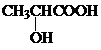 )的合成线路:
)的合成线路: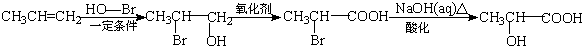 .
.